| Autore |
Discussione |
|
|
Federicax1989
Utente Junior


316 Messaggi |
 Inserito il - 13 giugno 2009 : 00:26:38 Inserito il - 13 giugno 2009 : 00:26:38




|
Allora x quanto riguarda la definizione di punto isoelettrico tutto ok..ma nn capisco da cosa dipende e come si calcola.
Cioe' si calcola sapendo i pKa delle catene laterali e i pka si calcolano dalla titolazione.Si ma non ho capito i passaggi della titolazione della glicina e xk il punto isoelettrico e ' 6.6,(ovvero a meta' strada dei valori dei pka dei gruppi carbossilico e amminico..(parole del libro))
ps..ho trovato in dei vecchi messaggi una spiegazione :
La glicina a pH acido sarà tutta protonata (NH3+ e COOH) e avrà quindi carica +:
A pH basico avrai NH2 e COO- e quindi carica -
Ad un certo pH intermedio avrai carica NETTA 0 perchè avrai NH3+ e COO-
Questo pH è la media delle pKa di NH3 (~9.6) e COOH (~2.3), cioè ~5.95.
ok ci sono..ma nn capisco le parole del mio libro.Ve le scrivo:
Il gruppo + acido che reagisce x primo con NaOH e' il gruppo carbossilico.Quando sono state aggiunte 0.5 mol di NaOH il carbossile si e' neutralizzat per meta'.A questo puno la [H3NCH2COOH]=[H3NCH2COO-] ovvero [ione positivo[=[zwitterione].
Il punto finale della prima parte delle titolazione viene raggiunto quando e' stata aggiunta uan mole di NaOH.Aquesto punto la specie predominante e' lo zwitterione e il pH e' 6.06.
|
|
|
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 13 giugno 2009 : 00:45:17 Inserito il - 13 giugno 2009 : 00:45:17





|
Citazione:
Messaggio inserito da Federicax1989
Allora x quanto riguarda la definizione di punto isoelettrico tutto ok..ma nn capisco da cosa dipende e come si calcola.
...ovvero a meta' strada dei valori dei pka dei gruppi carbossilico e amminico..
 mmm mmm
se hai capito la definizione, dovresti aver capito come si calcola, almeno per aminoacidi semplici come la glicina che hanno solo gruppo amminico e carbossilico, comunque puoi leggerti la spiegazione su wikipedia, è spiegato in modo veramente semplice.
http://it.wikipedia.org/wiki/Punto_isoelettrico |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 13 giugno 2009 : 01:27:05 Inserito il - 13 giugno 2009 : 01:27:05





|
Scusa hai modificato il messaggio mentre stavo rispondendo!
Comunque per rispondere alla nuova domanda:
Citazione:
Messaggio inserito da Federicax1989
Questo pH è la media delle pKa di NH3 (~9.6) e COOH (~2.3), cioè ~5.95.
Ok considerando questi valori viene 5.95!
Citazione:
Messaggio inserito da Federicax1989
ok ci sono..ma nn capisco le parole del mio libro.Ve le scrivo:
..... e il pH e' 6.06.
Il libro invece considera questi valori:
pKa di NH3 = 9.78
pKa di COOH = 2.35
(gli stessi che trovi nella tabella di Wikipedia: Amminoacidi - Proprietà chimiche)
quindi: (9.78 + 2.35)/2 = 6.06
qua considerano 9.6 e 2.34, quindi viene 5.97: http://www.scienzeascuola.it/public/titolazione_glicina.pdf
Ma non è che ci siano delle grosse differenze tra pH 5.95, 5.97 o 6.06!
Il procedimento comunque è quello!
 |
 |
|
|
Federicax1989
Utente Junior


316 Messaggi |
 Inserito il - 13 giugno 2009 : 10:44:42 Inserito il - 13 giugno 2009 : 10:44:42




|
| MA mica nn capivo xk i risultati erano diversi..nn capisco i passaggi della titolazione |
 |
|
|
Federicax1989
Utente Junior


316 Messaggi |
 Inserito il - 13 giugno 2009 : 11:11:38 Inserito il - 13 giugno 2009 : 11:11:38




|
Uh raga..credo di aver trovato un file perfetto.Ve lo faccio leggere cosi' mi dite anche voi se va bene e se devo aggiungere qualcosa:
Il punto isoelettrico di un aminoacido è rappresentato dal valore di pH al quale la sua carica interna netta è pari a zero ed è uguale alla media aritmetica delle pK di un amminoacido.
Prendiamo ad esempio la glicina che ha il valore di pKa della funzionalità carbossilica pari a 2,34 e il valore di pKb della funzionalità amminica pari a 9,60.
Questo vuol dire che a valori di pH inferiori a 2,34 il suo carbossile sarà più presente nella forma non dissociata e l'ammina sarà prevalentemente protonata.
A pH maggiore di 9,60 si verifica l'opposto con il carbossile privo dell'idrogeno e con l'azoto non ionizzato.
Il punto isoelettrico della glicina, pertanto sarà dato dalla media tra il valore del pK del gruppo carbossilico ed il valore del pK del gruppo amminico (PI=5,97).
1) Nell’ambiente all'inizio la concentrazione di H+ è molto alta, essendo il pH della soluzione basso, per cui i gruppi ionizzabili dell’amminoacido avranno più facilità ad acquisire protoni H+ dall’ambiente (trasformandosi nelle due forme protonate COOH e NH3+) piuttosto che a cederli. L’amminoacido presenta quindi una carica neutra sul gruppo carbossilico ed una carica positiva su quello amminico.
R
H3+N - C - COOH
H
Diremo allora che si presenta nella sua forma cationica.
Aggiungiamo ancora OH- e notiamo che il pH gradualmente aumenta. Questo vuol dire che diminuisce la concentrazione di H+ in soluzione diminuisce e l’amminoacido comincia a cedere gli H+ per ripristinare l’equilibrio.
Il primo gruppo che cede H+ è quello carbossilico:
cominciano quindi ad aumentare gli amminoacidi con COO- e a diminuire quelli con COOH fino a quando la concentrazione di entrambi in soluzione si eguaglia: abbiamo raggiunto il valore di pH della soluzione pari al pKa.
Continuiamo ad aggiungere ioni OH-, così che il numero degli amminoacidi che cedono H+ dal gruppo COOH continua ad aumentare fino a quando tutti i gruppi carbossilici sono presenti nella forma dissociata COO-. A questo punto abbiamo l’amminoacido recante carica negativa sul gruppo carbossilico e ancora carica positiva su quello amminico:
R
H3+N - C - COO-
H
L’amminoacido ha dunque carica netta neutra pari a 0 per cui diciamo che si presenta nella sua forma zwitterionica. Il valore di pH al quale l’amminoacido si presenta nella sua forma zwitterionica corrisponde al cosiddetto punto isoelettrico.
Continuiamo ad aggiungere NaOH alla soluzione e il pH continua ad aumentare così come diminuiscono gli idrogenioni H+ in soluzione. Data la scarsità di idrogenioni l’amminoacido preferisce cedere gli H+ che ancora porta legati ai gruppi amminici NH3+ piuttosto che acquisire H+ dalla soluzione: cominciano quindi a diminuire gli amminoacidi recanti il gruppo amminico dissociato come NH3+ e ad aumentare quelli recanti il gruppo amminico dissociato come NH2 fino a quando la concentrazione di entrambi in soluzione si eguaglia: abbiamo raggiunto il valore di pH della soluzione pari a pKb.
Se continuiamo ad aggiungere NaOH e a diminuire la concentrazione di idrogenioni della soluzione anche i restanti gruppi amminici carichi dissociano il protone fino a quando tutti i gruppi amminici si presenteranno nella forma non carica NH2. A questo valore di pH l’amminoacido presenterà carica negativa sul gruppo carbossilico e carica neutra sul gruppo amminico:
R
N2H - C - COO-
H
L’amminoacido si trova nella forma anionica.
Possiamo dunque riassumere dicendo che a valori di pH più bassi del punto isoelettrico (quando sono tanti gli H+ della soluzione) l’amminoacido si comporta da base acquisendo H+ dalla soluzione e la forma predominante dell’amminoacido sarà quella protonata carica positivamente o cationica; a valori di pH più alti del punto isoelettrico (quando ci sono pochi H+ in soluzione) l’amminoacido si comporterà da acido cedendo protoni alla soluzione e la forma predominante sarà quella carica negativamente deprotonata o anionica.
|
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 13 giugno 2009 : 18:20:17 Inserito il - 13 giugno 2009 : 18:20:17





|
Ok, scusa ma non mi era chiaro il tuo dubbio!
Quello che hai scritto ora è giusto.
Diciamo che una cosa è il calcolo del punto isoelettrico sapendo pKa (NH3+) e pKa (COOH), si applica semplicemente la formula:
pKa (NH3+) + pKa (COOH)
2
Invece quando fai una titolazione, fai una cosa pratica, aggiungi NaOH e si passa man mano dalle varie forme:
+H3N - CH2 - COOH ---> +H3N - CH2 - COO- ---> H2N - CH2 - COO-
forma cationica zwitterione forma anionica
secondo il processo che hai scritto.
Durante la titolazione raggiungerai il punto isoelettrico a quel valore di pH che hai calcolato con la formula.
Questa è una rappresentazione grafica del processo:
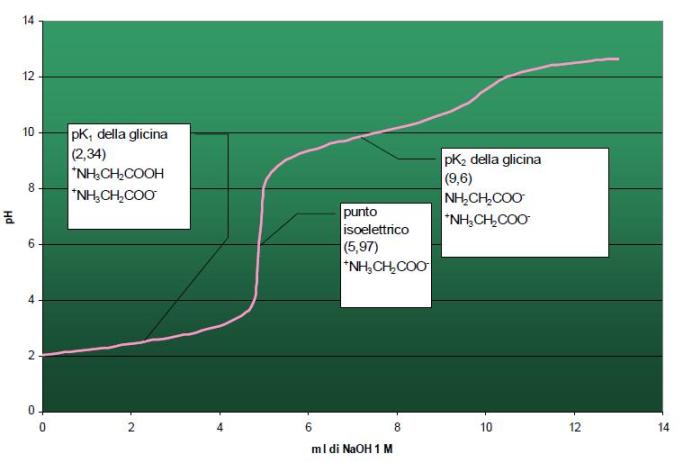
Spero tutto sia chiaro ora.
Altrimenti anche qui trovi una spiegazione semplice: Titolazione di un amminoacido con catena laterale non ionizzabile
 
P.S. se vuoi che il testo rimanga allineato utilizza il tag code  [code ][ /code] [code ][ /code] |
 |
|
|
badmanf85
Nuovo Arrivato

12 Messaggi |
 Inserito il - 07 luglio 2010 : 13:17:27 Inserito il - 07 luglio 2010 : 13:17:27




|
ok ci sono..ma nn capisco le parole del mio libro.Ve le scrivo:
Il gruppo + acido che reagisce x primo con NaOH e' il gruppo carbossilico.Quando sono state aggiunte 0.5 mol di NaOH il carbossile si e' neutralizzat per meta'.A questo puno la [H3NCH2COOH]=[H3NCH2COO-] ovvero [ione positivo[=[zwitterione].
Il punto finale della prima parte delle titolazione viene raggiunto quando e' stata aggiunta uan mole di NaOH.Aquesto punto la specie predominante e' lo zwitterione e il pH e' 6.06.
La base stacca prima gli H più acidi e poi quelli meno acidi, qundi se hai +NH3-CHR-COOH (a pH 2) e aggiungi NaOH, quali sono gli H più acidi? quelli del gruppo COOH (pka 10-5) rispetto a quelli del NH3+ 10-9, allora all'aggiunta di un eq di NaOH avrai la Forma Zwitterionica NH3+ e COO-, una volta aggiunte un'altra mezza qntità di NaOH (1 eq e mezzo) la base staccherà gli H più acidi (non ce ne sono più sul gruppo carbossilico e l'unica funzione acida è qulla NH3+) dando la forma anionica NH2-CHR-COO-
Allegato:  amminoacidi.pdf amminoacidi.pdf
372 KB |
 |
|
| |
Discussione |
|





