| Autore |
Discussione |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 03 febbraio 2012 : 09:22:37 Inserito il - 03 febbraio 2012 : 09:22:37




|
Ciao a tt, ho bisogno di un aiuto...una domanda del compito di biochimica strutturale era questa:
dava dei valori numeri del gruppo carbossilico e del gruppo amminico di questi aa:Aspartato, glutammato,arginina e lisina...mi chiedeva di spiegare le differenze e commentare...
NON LO SO :(
vi prego rispondetemi :( sn un pò disperata....

|
amelu |
|
|
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 03 febbraio 2012 : 10:11:52 Inserito il - 03 febbraio 2012 : 10:11:52




|
Beh, prova a cominciare a scrivere la definizione di Ka e disegnare le strutture dei 4 aminoacidi.
Riesci a trovare una correlazione fra la struttura ed il valore di Ka? Un Asp è ben diverso da una Lys...
|
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 03 febbraio 2012 : 10:19:55 Inserito il - 03 febbraio 2012 : 10:19:55




|
| tutto questo mi da la risposta che cerco? no..... per niente |
amelu |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 03 febbraio 2012 : 10:41:47 Inserito il - 03 febbraio 2012 : 10:41:47




|
Rispondi alle mie domande, rifletti e vedrai che avrai la risposta.
Almeno provaci così ci ragioniamo insieme (sorry, niente pappa pronta su questo forum) |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
0barra1
Utente Senior
   

Città: Paris, VIIème arrondissement

3847 Messaggi |
 Inserito il - 04 febbraio 2012 : 13:01:56 Inserito il - 04 febbraio 2012 : 13:01:56




|
Citazione:
Messaggio inserito da amelu
tutto questo mi da la risposta che cerco? no..... per niente
Studiando? si... decisamente
Quoto chick, concentrati sulla struttura dei vari aa e sugli effetti che i gruppi adiacenti al gruppo carbossilico possono avere su di esso. |
So, forget Jesus. The stars died so that you could be here today.
A Universe From Nothing, Lawrence Krauss
|
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 04 febbraio 2012 : 14:18:28 Inserito il - 04 febbraio 2012 : 14:18:28




|
| ma quanto siete scortesi però.... |
amelu |
 |
|
|
0barra1
Utente Senior
   

Città: Paris, VIIème arrondissement

3847 Messaggi |
 Inserito il - 04 febbraio 2012 : 14:23:28 Inserito il - 04 febbraio 2012 : 14:23:28




|
A me pare che qui ci sia chick che ti abbia aiutato a PENSARE, ricevendo una risposta ben poco gentile in cambio. Quindi io ti ho fatto notare che effettivamente lui aveva ragione e ti ho dato un'altra piccola dritta.
Tutta questa scortesia non la vedo.
Ne la vedono tantissimi altri utenti che qui hanno trovato aiuto per i loro problemi.
Poi chissà, siamo tutti noi che ci sbagliamo e l'unica educata/o sei tu 
PS: e discutendo così non compi nessun passo avanti nella soluzione del tuo quesito.
PPS: se il gruppo carbossilico perde un idrogeno, avremo una carica negativa che viene parzialmente stabilizzata per risonanza. Però non limitarti a considerare questo fenomeno, in prossimità del carbossilato si trovano altri gruppi. Che effetto ha un altro gruppo carbossilato (come in Asp e Glu)? Che ruolo gioca la distanza tra i due gruppi carbossilati? E se invece di un COO- avessimo un gruppo carico positivamente (es. Lys?)?
Ecco, spero tu possa trovare più spunti qui. |
So, forget Jesus. The stars died so that you could be here today.
A Universe From Nothing, Lawrence Krauss
|
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 04 febbraio 2012 : 14:54:26 Inserito il - 04 febbraio 2012 : 14:54:26




|
Scusami, ma io ti do degli indizi per farti ragionare sul problema (in modo che tu possa capire come farlo all'esame ad es.) e tu mi rispondi dicendo che la mia risposta non serve a nulla. E sono io quello scortese?
Ribadisco, su questo forum siamo più che contenti di risolvere esercizi ma, visto che lo facciamo gratuitamente e per nostro piacere personale, vogliamo che la persona che ci pone la domanda mostri almeno la buona volontà di provare a risolvere l'esercizio.
Ora, se mi stai dicendo che non sai trovare la differenza fra una lisina e un glutammato ti sconsiglio di presentarti all'esame. Altrimenti scrivi il tuo ragionamento -anche se sbagliato- (se vuoi seguendo gli enormi indizi che ti abbiamo scritto) e procederemo insieme alla risoluzione. Ma la risposta pronta non te la daremo, perchè non serve a nulla.
Infine, ti faccio notare che se avessi risposto alla mia domanda, invece di contestare, avremmo già risolto il problema da un bel po' di tempo.
 |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 04 febbraio 2012 : 14:56:41 Inserito il - 04 febbraio 2012 : 14:56:41




|
avete tt e 2 RAGIONE,ci sto ragionando...dopo scrivo, PROMESSO!!
a dopo!! |
amelu |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 04 febbraio 2012 : 18:23:53 Inserito il - 04 febbraio 2012 : 18:23:53




|
Allora ragazzi, penso di aver 'risolto' il mio quesito...e quindi la domanda del compito,ora vi scrivo esattamente come avrei risposto io,
vi prego quindi di correggermi qualora pensiate nn ho scritto in modo chiaro on sbagliato.
RISPOSTA:
considerando che il pKa è la forza di un acido a cedere un H+, + piccolo è il pKa, + forte è l'acido.
Questo valore presenta essere associato al pH della soluzione.
Inoltre i valori di pKa degli aa all'interno di una catena polipt,in cui i gruppi COOH ed NH2 sono impegnati in legami,possono essere diversi rispetto gli aa liberi.
Considerando gli aa che possiedono delle catene laterali neutre (es. aa alifatici....GIUSTO???? oppure?) oppure?)
questi presentano solo 2 gruppi ionizzabili, cioè alfa-carbossilico e l'alfa-amminico.
Mentre x aa con catene laterali carichi come: Asp,Glu,Arg, Lys la situazione è diversa, il valore di pKa dei vari gruppi ci da info sulla capacità o meno di cedere H+.
In particolare x L'asp e Glu presentano 2 cariche negative contro 1 positiva, quindi questi a pH7 saranno sempre allo stato anionico e presentano essere ACIDI FORTI in quanto in soluzione xdono il protone, però se il pH della sluzione tende ad abbassarsi sarà+ difficile xloro perdere i protoni dei 2 gruppi carbossilici.
mentre
per l'Arg e Lys individuiamo la presenza di 2 cariche positive contro 1 negativa, apH7 si trovano questi allo stato cationico e rappresentano essere delle basi forti in quanto possiedono un doppietto e catturano il protone e diventano NH3+.
Anche questo comportamento cmq dipende dal valore di Ph della soluzione, infatti a pH basso, l'NH2 verrà protonato diventando NH3+, a pH alto L'NH2 sarà deprotonato in NH.
 ALLORA....avrei scritto cosi, che dite? bocciata o promossa? ALLORA....avrei scritto cosi, che dite? bocciata o promossa?
PS: volevo tanto tanto tanto tanto tanto RINGRAZIARVI per avermi spronata a risolvere da me questo quesito (sinceramente...abbastanza semplice) e ad avermi condotta a RAGIONARE....molto meglio di avermi dato direttamente la risposta, MOLTO MOLTO MEGLIO.
aspetto vostre valutazioni.
PSS: grazie grazie grazie  |
amelu |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 05 febbraio 2012 : 10:24:02 Inserito il - 05 febbraio 2012 : 10:24:02




|
allora, nessuna risposta??  |
amelu |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 05 febbraio 2012 : 11:28:58 Inserito il - 05 febbraio 2012 : 11:28:58




|
Vediamo un po'... metto innanzitutto per comodità le strutture dei 4 aa
Glu: 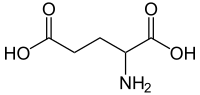
Asp: 
Arg: 
Lys: 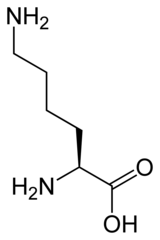
Citazione:
considerando che il pKa è la forza di un acido a cedere un H+, + piccolo è il pKa, + forte è l'acido.
Ok, facendo attenzione che una definizione più corretta di pKa è: la "costante di dissociazione acida", che è inversamente proporzionale alla tendenza di un acido a dissociarsi.
Citazione:
Inoltre i valori di pKa degli aa all'interno di una catena polipt,in cui i gruppi COOH ed NH2 sono impegnati in legami,possono essere diversi rispetto gli aa liberi.
Considerando gli aa che possiedono delle catene laterali neutre (es. aa alifatici....GIUSTO???? oppure?)
questi presentano solo 2 gruppi ionizzabili, cioè alfa-carbossilico e l'alfa-amminico.
Mentre x aa con catene laterali carichi come: Asp,Glu,Arg, Lys la situazione è diversa, il valore di pKa dei vari gruppi ci da info sulla capacità o meno di cedere H+.
Esatto. Ricorda che non sono solo gli aminoacidi alifatici ad essere neutri, ma anche gli aminoacidi aromatici come la Phe ma anche aa come la Ser che hanno catene polari ma neutre. (vedi questa immagine o anche la mitica tavola periodica degli aa by domi).
Citazione:
In particolare x L'asp e Glu presentano 2 cariche negative contro 1 positiva, quindi questi a pH7 saranno sempre allo stato anionico e presentano essere ACIDI FORTI in quanto in soluzione xdono il protone, però se il pH della sluzione tende ad abbassarsi sarà+ difficile xloro perdere i protoni dei 2 gruppi carbossilici.
mentre
per l'Arg e Lys individuiamo la presenza di 2 cariche positive contro 1 negativa, apH7 si trovano questi allo stato cationico e rappresentano essere delle basi forti in quanto possiedono un doppietto e catturano il protone e diventano NH3+.
Anche questo comportamento cmq dipende dal valore di Ph della soluzione, infatti a pH basso, l'NH2 verrà protonato diventando NH3+, a pH alto L'NH2 sarà deprotonato in NH.
Un paio di correzioni importanti su questo discorso.
1) In generale una cosa molto importante da ricordare è che raramente gli acidi organici, soprattutto quelli che si trovano nel nostro organismo sono acidi forti (sai farmi un controesempio di acido forte nel nostro corpo? Dai, è facile!  ). ).
Se Asp e Glu fossero acidi forti sarebbero SEMPRE dissociati, in quanto la loro reazione di dissociazione sarebbe -per definizione di acido forte- irreversibile. Quindi tutti e 4 gli aminoacidi sono acidi deboli e basi deboli. Ancora meglio parlare di zwitterioni.
2) La tua teoria sul numero di cariche positive e negative non regge.
Asp e Glu non hanno "2 cariche - ed una carica +", ma hanno 2 COOH e un NH2, che possono o meno essere protonati, quindi non puoi basarti sul numero di carbossili per determinarne l'acidità di uno specifico carbossile...
Ricorda che stai parlando delle pK del COOH e NH2 in alfa, quindi la domanda è "come la presenza di un COOH o di un NH2 nella catena laterale influenza la pK dei gruppi in alfa?".
E' molto importante in questi casi ragionare sui numeri e sulle strutture (vedi anche l'indizio che ti ha dato 0/1 prima).
Andiamo a vedere su Wikipedia le pK dei diversi aa (vedi: http://en.wikipedia.org/wiki/Proteinogenic_amino_acid#Chemical_properties ):
Ecco i nostri 4 aa (+ 3 aa neutri di confronto)
aa | pK (COOH) | pK (NH3+)
-------|-----------|-----------
Glu | 2.10 | 9.47
Asp | 1.99 | 9.90
Arg | 1.82 | 8.99
Lys | 2.16 | 9.06
-------|-----------|-----------
Ala | 2.35 | 9.87
Ile | 2.32 | 9.76
Trp | 2.46 | 9.41
Concentriamoci ad es. sugli aa basici (Arg e Lys). La pK(COOH) dell'Arg è più bassa di quella della Lys. Vuol dire che è più facile che l'Arg presenti un COO- piuttosto che la Lys. Per entrambe la dissociazione del COOH in alfa è maggiore rispetto ad un aa neutro. Inoltre non sembra esserci un rapporto diretto fra acidità o basicità dell'aa e la dissociazione del COOH in alfa!
Guarda la struttura dei vari aa: ti viene in mente qualcosa per spiegare questo comportamento? |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 05 febbraio 2012 : 12:17:49 Inserito il - 05 febbraio 2012 : 12:17:49




|
tavola periodica degli aa by domi.... MERAVIGLIOSA
acidi nel nostro corpo:
-ac. cloridico --> stomaco
-ac. lattico -->muscoli
....non sono molto immediata nei ragionamenti, fammi pensare un pò...poi scrivo tutto.
PS: grazie tante  |
amelu |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 05 febbraio 2012 : 12:55:16 Inserito il - 05 febbraio 2012 : 12:55:16




|
ha ragione chick il ragionamento sulle cariche non è giusto...il fatto che sia ionizzato o meno dipende dal solvente,mentre il ragionamento sulle cariche si può fare solo sulle basi coniugate quando c'è risonanza e poi a parità di risonanza si vedono gli atomi più elettronegativi...
ti ricordo che si dimostra che l'equilibrio acido-base va in direzione dell'acido con il pka minore!
Per gli A. parti a livello strutturale da un acido carbossilico pka circa 5,per un Am semplice c'è l'influenza di un gruppo elettron-attrattore che sposta il pka a circa 2,3...poi continua a ragionare sui sostituenti elettron attrattori o donatori che possono essere lungo il legame sigma o per risonanza  |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 05 febbraio 2012 : 15:17:28 Inserito il - 05 febbraio 2012 : 15:17:28




|
allora: sto cercando di comprendere fino in fondo....CON UN Pò DI DIFFICOLTà nel capire esattamente quale ragionamento devo seguire per ogni aa.
Io considero questo:
il pK del COOH e NH2 in alfa presentano essere influenzati dai gruppi COOH E NH2 che troviamo nelle catene laterali degli aa quindi importanza rilevante hanno gli aa con R carichi e nn quelli neutri (penso).
considerando che stiamo parlando di pKa, la prima cosa da considerare è quindi il valore di pKa del gruppo COOH,se questo ha un valore molto basso (inferiore a 2) allora capisco che tenderà a cedere facilmente il suo protone e quindi lo definisco: un acido...stessa cosa per una base se ha un valore maggiore di 8, tenderà ad acquistare un H+.
chim2...mi dispiace,ma nn sei stato affatto chiaro :,(
ho bisogno di comprendere il ragionamento CHIARO ED ESATTO che devo seguire nel ragionamento.
help me please.
  |
amelu |
 |
|
|
chim2
Utente Attivo
  


2110 Messaggi |
 Inserito il - 05 febbraio 2012 : 16:37:45 Inserito il - 05 febbraio 2012 : 16:37:45




|
perchè lo definisci acido a priori?
Per il resto puoi anche rispulciare un testo di organica  |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 05 febbraio 2012 : 20:46:47 Inserito il - 05 febbraio 2012 : 20:46:47




|
Ti faccio un esempio di come ragionare, prendendo come esempio Arg e Lys
Arg ha un gruppo guanidinico sulla catena laterale, che è praticamente sempre protonato (ha una pKa di 12.48!). Questo gruppo ha quindi un effetto elettron attrattore.
Nota le formule di risonanza del guanidinio:

Il guanidinio, quindi, renderà più "facile" la deprotonazione del COOH in alfa a dare COO-.
L'effetto si farà sentire allo stesso modo sul gruppo aminico in alfa, che quindi sarà meno basico.
La Lys, invece, è l'aminoacido meno acido, con una pK del COOH in alfa che si avvicina di più a quella di un aa neutro. Questo perchè 1) la sua catena laterale è lunga e priva di legami coniugati, diminuendo l'effetto del gruppo aminico laterale. L'effetto sembra essere un po' più forte sull'NH2 in alfa, probabilmente perchè comunque attorno a pH 9 la catena laterale sarà ancora protonata (il gruppo aminico ha una pKa di 10.54). |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 06 febbraio 2012 : 19:12:42 Inserito il - 06 febbraio 2012 : 19:12:42




|
ho saputo un'altra domanda del compito:
IL PROF DA DEI VALORI DI pK e di pKa...in base a quello che leggiamo dobbiamo definire che aa costituiscono la catena polipeptidica.
ORA,se prendo lo schema che mi hai dato tu:
aa | pK (COOH) | pK (NH3+)
-------|-----------|-----------
Glu | 2.10 | 9.47
Asp | 1.99 | 9.90
Arg | 1.82 | 8.99
Lys | 2.16 | 9.06
-------|-----------|-----------
Ala | 2.35 | 9.87
Ile | 2.32 | 9.76
Trp | 2.46 | 9.41
vedo che i valori di pk sono tutti molto simili traloro, come faccio quindi a capire di che aa stiam oparlando? :( |
amelu |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 06 febbraio 2012 : 19:14:27 Inserito il - 06 febbraio 2012 : 19:14:27




|
| ok, questi valori sono definiti per i gruppi CCOH ed NH3 ok....se mi da il valore del pKa dell'aa...come faccio a capire di quale aa stiamo parlando??dovrei saperli tt a memoria?no vero?? |
amelu |
 |
|
|
0barra1
Utente Senior
   

Città: Paris, VIIème arrondissement

3847 Messaggi |
 Inserito il - 06 febbraio 2012 : 19:19:25 Inserito il - 06 febbraio 2012 : 19:19:25




|
Mai sentito di professori che chiedano tutti i pKa a memoria.
Ricordati che per il COOH il pKa è attorno a 2 e per l'NH3 intorno a 9. Non dimenticare poi i pKa di certe catene laterali, come l'istidina, in quanto giocano un ruolo importante in ambito biologico. |
So, forget Jesus. The stars died so that you could be here today.
A Universe From Nothing, Lawrence Krauss
|
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 06 febbraio 2012 : 20:31:01 Inserito il - 06 febbraio 2012 : 20:31:01




|
| ok, ma come faccio a capiredi che aa stiamo parlando solo ricevendo questa info? :( |
amelu |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 06 febbraio 2012 : 21:42:48 Inserito il - 06 febbraio 2012 : 21:42:48




|
Citazione:
IL PROF DA DEI VALORI DI pK e di pKa...in base a quello che leggiamo dobbiamo definire che aa costituiscono la catena polipeptidica.
Non sarà mai così l'esercizio, a meno che il prof non vi dia anche una sfera di cristallo.
Quello che vi darà saranno i valori di pKa e magari il pI dell'aa, o ti scrive la struttura di una catena polipeptidica e ti dà vari valori di pK da assegnare. Altrimenti non è possibile rispondere al quesito (a meno di non sapere a memoria tutte le Ka, cosa che non è inutile, di più!) |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
amelu
Utente Junior



132 Messaggi |
 Inserito il - 06 febbraio 2012 : 23:20:25 Inserito il - 06 febbraio 2012 : 23:20:25




|
MENO MALEEEEEEEEEEEEEEEEEEEE....mi hanno dato un'info che si sn inventati e w   |
amelu |
 |
|
| |
Discussione |
|







 ALLORA....avrei scritto cosi, che dite? bocciata o promossa?
ALLORA....avrei scritto cosi, che dite? bocciata o promossa?




