Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 23 maggio 2013 : 20:19:50 Inserito il - 23 maggio 2013 : 20:19:50




|
Salve, sto scrivendo la tesi e mi sono imbattuto in un problema con excel, nel senso che la retta di regressione non mi da il risultato che mi aspetto.
Allora, mettiamo che io voglia costruire una retta di taratura usando uno standard noto.
Prendo 3 diluizioni di BSA, 2,5mcg/ml, 5mcg/ml e 10mcg/ml, e trovo questi valori di assorbanza:
2,5mcg/ml = 0,165
5mcg/ml = 0,303
10mcg/ml = 0,544
Ora, volendo calcolare il coefficiente di estinzione in mcg/ml, se faccio semplicemente una media dei tre valori mi esce fuori 0,603.
Se invece provo a costruite una retta di regressione con excel mi trovo questo risultato.
Sinceramente dovendo preparare una tesi preferirei dire di aver utilizzato la retta di regressione su excel, però non capisco perchè mi dia questi dati.
Immagine:

24,41 KB
|
|
|
|
|
domi84
Moderatore
  

Città: Glasgow

1724 Messaggi |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 09:47:04 Inserito il - 24 maggio 2013 : 09:47:04




|
| Non capisco perchè il coefficiente angolare calcolato facendo la media dei tre valori sia diverso dal coefficiente calcolato con la retta di regressione... |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 24 maggio 2013 : 09:51:28 Inserito il - 24 maggio 2013 : 09:51:28





|
Sinceramente non capisco dove stia la tua perplessità.
Dai tuoi calcoli ottieni 0,603 mentre la pendenza della retta che ti da excel è 0,0561.
Le differenze sono dovute a due fattori:
1) così calcoli il coefficiente di estinzione percentuale (di una soluzione 1% = 10mg/ml) e nei tuoi conti hai giustamente moltiplicato per 10 (almeno credo che tu lo abbia fatto altrimenti non avresti ottenuto quel risultato!)
Excel disegna la retta con i valori che tu gli hai dato e di certo non ti moltiplica per 10 la pendenza, ma puoi farlo benissimo tu, ottenendo 0,561
A questo punto i valori sono ben più vicini! Manca il secondo punto:
2) il tuo calcolo è fatto sulle medie, mentre il calcolo di excel è fatto con una interpolazione lineare e come puoi ben vedere "nessuno" dei tuoi punti è esattamente sulla retta i valori "sulla retta" sono leggermente diversi e quindi è normale che anche la pendenza non sia "esattamente" quella calcolata.
Un punto invece che risulta oscuro a me è: che unità di misura è "mcg"? sta forse per microgrammi? In genere si usa la lettera greca "mu" (o "mi) a volte sostituita da "u" se non ci sono i caratteri greci.
Comunque sia il discorso che ho fatto sopra era considerando le concentrazioni in mg/ml, per il resto non mi trovo con i tuoi valori. Il coefficiente di estinzione percentuale della BSA dovrebbe venire attorno a 6,6 poi che tu abbia 6,03 o 5,61 va beh ci sta anche ma non mi torna molto qualcosa del tipo 0,6...
Se fai la controprova usando il valore tabulato di 6,6 per i tuoi valori di assorbanza:
ad es. 0,544/6,6 x 10 = 0,8 mg/ml
ammettiamo anche che ci sia un errore sperimentale e diciamo che sia 1mg/ml, 10microgrammi/ml è un po' diverso!
Boh magari mi sono persa qualche passaggio io! |
 |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 10:54:04 Inserito il - 24 maggio 2013 : 10:54:04




|
Scusami sono stato impreciso, volevo dire che il valore che esce dalla media dei 3 coefficienti di estinzione è 0,0603.
mcg sta per microgrammi, così ho semplicemente calcolato il coefficiente di estinzione in microgrammi/ml.
Dovrebbe andare bene anche in questa unità di misura no?
Il dubbio che mi sorgeva è quale sia il calcolo più adeguato da usare, se la retta di regressione costruita col metodo dei minimi quadrati oppure una semplice media dei valori.
|
 |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 11:06:21 Inserito il - 24 maggio 2013 : 11:06:21




|
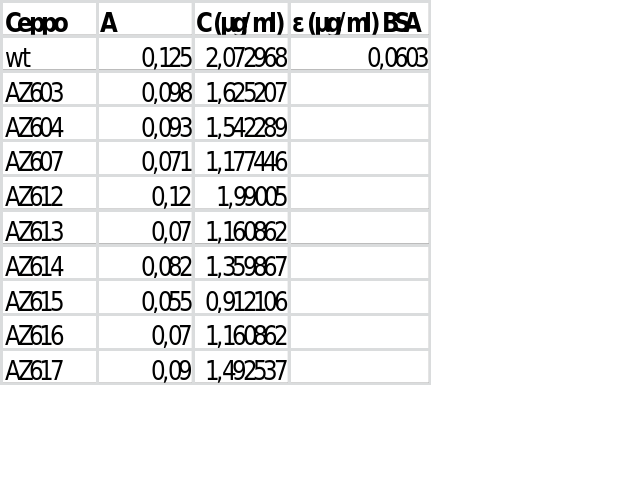
Qui c'è un'immagine per farti vedere come ho calcolato la concentrazione delle estrazioni proteiche dei vari ceppi.
Immagine:
51,18 KB |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 24 maggio 2013 : 12:18:54 Inserito il - 24 maggio 2013 : 12:18:54





|
Puoi esprimerlo con l'unità di misura che vuoi, purché sia corretta però!
Innanzitutto le tue unità di misura del coef. di estinzione sono sbagliate! Le unità di misura solo l'inverso della concentrazione, non uguali.
Quindi se la tua concentrazione è in ug/ml il coef. di estinzione è in ml/ug, se la concentrazione è mg/ml il coef. di estinzione è in ml/mg.
Dato che la relazione è questa: (considero la lunghezza uguale a 1)
C = A/epsilon
mg/ml = A/(ml/mg)
Poi a parte questo il valore di 0,0603 non può corrispondere a ml/ug!
Ora lasciamo perdere che i valori che hai trovato tu sono un po' inferiori a quelli tabulati, consideriamo solo il "6" per semplicità, tu hai un valore di 0,06
Se il valore tabulato è di 6,6 per 10mg/ml che semplifico a 6 avrai:
10mg/ml 6 ml/10mg
1mg/ml 0,6 ml/mg
1ug/ml 0,0006 ml/ug
quindi c'è un fattore 100 di differenza, quindi o hai sbagliato qualcosa o cosa molto più plausibile non hai letto le soluzioni pure ma una hai fatto una diluizione 1:100!
Poi i conti ti vengono uguali perché dovresti dividere il tuo coefficiente per 100 per averlo in ml/ug e poi moltiplicare le tue concentrazioni per 100 che è il fattore di diluizione, ma detto come hai scritto tu è sbagliato! E soprattutto visto che stai scrivendo la tesi, non scriverei cose del genere.
Poi per rispondere alla tua domanda, ovvero se usare il valore calcolato sulle medie o quello della retta, è meglio usare il valore ottenuto dalla retta.
Poi tieni presente che la quantificazione del proteine è un metodo mooooolto impreciso e qualunque cosa tu faccia non avrai mai la concentrazione delle proteine nel tuo campione ma una stima abbastanza imprecisa.
Innanzitutto tu prendi un campione dove ci sono tante proteine diverse e lo paragoni ad una proteina sola purificata.
Per farti un esempio stupido mangiare 10 mele non è la stessa cosa che mangiare 10 frutti visto che 1 frutto può essere una ciliegia ma anche un melone.
Ogni proteina ha un coefficiente di estinzione diverso, ad es. per le immunoglobuline è epsilon% è 14, che è più del doppio del 6,6 della BSA.
Poi sarebbe più corretto fare più letture a diverse diluizioni dei campioni prendere i valori che stanno nella curva (i tuoi campioni sono tutti fuori!) e fare una media di quei valori.
Il fatto di fare una singola diluizione e di prendere valori fuori dalla curva che vengono estrapolati e non sono molto affidabili purtroppo anche se sbagliato viene fatto in molti laboratori e quindi va beh, se ti hanno fatto fare così passi, ma almeno ricontrolla i conti e le diluizioni e "fai attenzione a come scrivi le unità di misura"! |
 |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 15:44:18 Inserito il - 24 maggio 2013 : 15:44:18




|
Sto andando parecchio in confusione, uff...
In laboratorio la dottoranda che mi seguiva i calcoli li ha fatti in questo modo.
Ha calcolato il valore medio di assorbanza per la soluzione contenente 5ug/ml ed ha fatto una proporzione.
0,300 : 5ug/ml = A : x
In quest caso la x sarebbe la concentrazione dell'estratto proteico.
Lo stock di BSA usato per preparare le diluizioni conteneva 0,5 ug/ul e noi abbiamo preparato le cuvette aggiungendo 5, 10 e 20 ul e portando poi al volume di 800ul con acqua e 200 di reagende Bradford fino al totale di 1ml.
A questo punto le concentrazioni nelle cuvette dovrebbero essere quelle che ho riportato, non capisco come mai i conti non tornino...
|
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 24 maggio 2013 : 18:18:30 Inserito il - 24 maggio 2013 : 18:18:30





|
Ah hai fatto un Bradford!
Certo allora è ovvio che hai valori diversi.
Il coefficiente di estinzione percentuale della BSA (6,6) è relativo all'assorbanza della BSA a 280nm, lunghezza d'onda a cui si leggono le proteine.
Tu però hai usato un metodo colorimetrico in cui hai un colorante (Coomassie) che si lega alle proteine e leggi l'assorbanza a 595nm, ovviamente i valori sono diversi!
Quindi ok non consideriamo più il fatto che il tuo valore sia diverso perché stavamo parlando di cose diverse.
Ricapitolando:
- tu hai preparato delle diluizioni dello standard in questo modo:
Citazione:
Lo stock di BSA usato per preparare le diluizioni conteneva 0,5 ug/ul e noi abbiamo preparato le cuvette aggiungendo 5, 10 e 20 ul e portando poi al volume di 800ul con acqua e 200 di reagende Bradford fino al totale di 1ml.
ok, quindi hai ottenuto queste tre concentrazioni: 2,5 - 5 e 10ug/ml
che ti hanno dato quei valori di assorbanza che hai messo in grafico e hai fatto una regressione lineare ottenendo la tua curva standard.(3 punti sono un po' pochini per una curva standard, ma va bene)
A questo punto hai un valore di coefficiente angolare che ti darà "epsilon" che comunque è ml/ug (non scrivere ug/ml perché sarebbe sbagliato!)
Poi usando il tuo valore "epsilon" e valori di assorbanza dei tuoi campioni ne hai calcolato le concentrazioni in ug/ml.
Ma qua mi manca comunque un passaggio! Tu hai fatto il calcolo semplicemente facendo questo conto: C = A/epsilon
ma manca il fattore di diluizione! Non possono essere puri tuoi campioni perché a parte che dubito che tu abbia usato tutto il campione per dosarlo, ma comunque se gli hai messo il reattivo di Bradford lo hai diluito. Quindi risali al fattore di diluizione (come hai preparato il campione?) e aggiungilo al calcolo!
Questo sono le cose fondamentali (te le ho evidenziate in blu) che devi assolutamente correggere!
Poi il resto del discorso del post precedente (anche se non fondamentale) vale comunque:
1) i tuoi valori di assorbanza sono fuori dalla retta, non è una quantificazione affidabile.
ok sicuramente non è colpa tua, ti avranno fatto fare così, ma sappi che non è corretto.
Le concentrazioni vanno lette in un range in cui sono lineari (altrimenti non avrebbe senso usare come curva standard una retta) se tu sei "fuori" da questo range non è detto che la tua relazione tra assorbanza e concentrazione sia lineare, quindi se usi una equazione lineare sbagli a calcolare la concentrazione.
2) una singola lettura di un campione ad una singola concentrazione non è affidabile, andrebbero fatte più letture a diverse diluizioni controllando che siano nel range lineare e siano compatibili e facendone la media.
Molti purtroppo non lo sanno (o se ne fregano) e il risultato è che le concentrazioni sono sbagliate!
Giusto per farti capire cosa intendo ti faccio un esempio, questa è una quantificazione di un estratto proteico fatta saggiando il campione a diverse diluizioni:
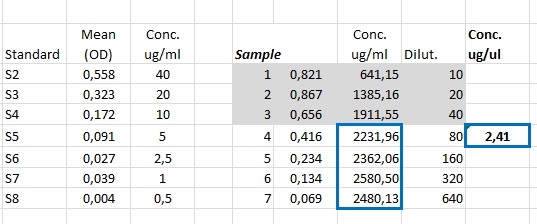
la media è stata calcolata solo sui valori che stanno all'interno della curva standard, quelli al di fuori (che come puoi ben vedere sono sballati!) sono stati eliminati.
Se fosse stata fatta un'unica diluizione, magari la prima, la concentrazione sarebbe stata "sbagliata".
Spero ora di essere stata più chiara e non averti creato ulteriore confusione!  |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 24 maggio 2013 : 18:23:01 Inserito il - 24 maggio 2013 : 18:23:01





|
Scusa ho letto ora questa cosa:
Citazione:
In laboratorio la dottoranda che mi seguiva i calcoli li ha fatti in questo modo.
Ha calcolato il valore medio di assorbanza per la soluzione contenente 5ug/ml ed ha fatto una proporzione.
0,300 : 5ug/ml = A : x
In questa caso la x sarebbe la concentrazione dell'estratto proteico.
No, questa cosa è sbagliatissima!
Ha usato un solo punto dello standard per calcolare le concentrazioni, allora a che serve fare la curva standard?
No assolutamente, mi raccomando non scrivere una cosa del genere nella tesi!!! |
 |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 19:28:14 Inserito il - 24 maggio 2013 : 19:28:14




|
Non so davvero come ringraziarti per il tempo che mi stai dedicando, grazie mille davvero!
Per quanto riguarda l'unità di misura dell'epsilon, mi sono reso conto di aver fatto un errore madornale, ed anche assurdo visto che salta all'occhio semplicemente guardando la legge di Labbert-Beer :S
Purtroppo in laboratorio hanno seguito tutt'altra strada per quantificare le proteine, e nella triennale si studia giusto un po' di teoria sui saggi colorimetrici, quindi mi trovo del tutto impreparato, ad esempio non sapevo di dover utilizzare il fattore di diluizione e a dire il vero non so neanche come usarlo.
Scrivo tutto il procedimento:
Dunque, in laboratorio avevamo uno stock di BSA a concentrazione di 0,5 mg/ml
Stock: 0,5 mg/ml, che forse risulta più comodo scrivere come 0,5 ug/ul
Da questo stock abbiamo preparato 3 diluizioni prelevando 5, 10 e 20 ul, quindi:
Soluzione 1: 5 ul (BSA) + 795 ul H20 + 200 ul di reagente Bradford
Fattore di diluizione: 1000ul/5ul = 200
Soluzione 2: 10 ul (BSA) + 790 ul H20 + 200 ul di reagente Bradford
Fattore di diluzione: 1000ul/10ul = 100
Soluzione 3: 20 ul (BSA) + 780 ul H20 + 200 ul di reagente Bradford
Fattore di diluzione: 1000ul/20ul = 50
Allora, nel preparare i campioni abbiamo aggiunto 2 ul di ogni campione in 798ul di H20 + 200ul di reagente Bradford.
Il fattore di diluizione quindi è: 1000 ul/2 ul = 500
Adesso cosa dovrei fare?
In laboratorio il metodo che abbiamo usato è stato fare la proporzione che ho riportato prima, dividendo poi i valori di assorbanza per 2, dal momento che volevamo la concentrazione su 1 ul, però ho già abbandonato da tempo l'idea di dire che abbiamo fatto una cosa del genere in seduta di laurea!:S
I valori di assorbanza che ho riportato in quella tabella quindi sarebbero i valori misurati divisi per 2.
I valori effettivamente misurati sarebbero il doppio di quelli che ho riportato in tabella.
|
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 24 maggio 2013 : 19:42:16 Inserito il - 24 maggio 2013 : 19:42:16





|
Allora direi che sulla curva standard siamo a posto!
Non c'è bisogno che vai a vedere qual è il fattore di diluizione perché comunque scrivi la loro concentrazione finale usi quella per fare la retta.
Per il campione è invece "fondamentale" sapere la sua diluizione perchè quello che a te interessa è la concentrazione del tuo campione, ovvio che se le leggi diluito 1:100 o 1:1000 è ben diverso otterrai dei valori diversi e "devi" rapportarli al fattore di diluizione altrimenti non sai cosa c'è nella tua provetta con il lisato proteico. Spero che questo sia chiaro.
Il conto da fare comunque è semplice, i valori di concentrazione che hai calcolato tu sono quelli della soluzione diluita, ora non fai altro che moltiplicarli per il fattore di diluizione.
ad es. il primo WT è 2,07 lo moltiplichi per 500 e ottieni: 1035ug/ml
quindi se vuoi lo puoi esprimere come 1,03ug/ul (o mg/ml)
e già è un valore che ha più senso! 
(si è la stessa cosa che dividere il valore "assoluto" per due, ma... attento alle unità di misura!)
Citazione:
In laboratorio il metodo che abbiamo usato è stato fare la proporzione che ho riportato prima, dividendo poi i valori di assorbanza per 2, dal momento che volevamo la concentrazione su 1 ul, però ho già abbandonato da tempo l'idea di dire che abbiamo fatto una cosa del genere in seduta di laurea!:S
sì decisamente molto meglio non dirlo! |
 |
|
|
masna
Nuovo Arrivato


74 Messaggi |
 Inserito il - 24 maggio 2013 : 20:09:46 Inserito il - 24 maggio 2013 : 20:09:46




|
Ok, adesso è tutto chiarissimo! Grazie infinite davvero! 
|
 |
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|








