| Autore |
Discussione |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 06 agosto 2009 : 14:54:35 Inserito il - 06 agosto 2009 : 14:54:35




|
Ciao a tutti.
Ho un problema nell'analizzare un omopolimero di un promotore... il fatto è che quando vado a sequenziarlo il sequenziatore produce un artefatto che impedisce di contare da quante T è composto l'omopolimero.
Ora, considerando che le conformazioni più frequenti sono T15 e T18, sarebbe utile poter discriminare i frammenti in maniera differente rispetto alla sequenza (che farei comunque per valutare altri polimorfismi).
Ho una situazione del genere:
TTTTTTTTTTTTTTTTTTNNNN
dove NNNN è il sito di restrizione per un enzima. Ora, pensavo di poter tagliare l'amplimero che contiene questo omopolimero in modo da poter discriminare se si tratti di un T15 o T18, ma il problema è che chi mi segue mi ha detto che non c'è nulla-che loro sappiano-che permetta di discriminare frammenti con differenze di 3nt...
Purtroppo non ho grande esperienza in laboratorio, ma voglio trovare una soluzione veloce che mi permetta di identificare l'omopolimero senza incasinarmitroppo...
voi cosa suggerite?
|
|
|
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 06 agosto 2009 : 14:57:46 Inserito il - 06 agosto 2009 : 14:57:46




|
| Credo che con un'elettroforesi su gel di acrilamide tu possa discriminare anche 1 solo nt, tuttavia non l'ho mai fatto, quindi non so darti protocolli esatti. |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
Dionysos
Moderatore
  

Città: Heidelberg

1913 Messaggi |
 Inserito il - 06 agosto 2009 : 18:23:06 Inserito il - 06 agosto 2009 : 18:23:06





|
Altrimenti potresti provare con un agarosio low melting,
ne esistono in commercio di tutti i tipi |
Volere libera : questa é la vera dottrina della volontà e della libertà
(F.W. Nietzsche)
Less Jim Morrison, more Sean Morrison!
|
 |
|
|
ukitel
Nuovo Arrivato

78 Messaggi |
 Inserito il - 06 agosto 2009 : 20:04:09 Inserito il - 06 agosto 2009 : 20:04:09




|
| Un'altra alternativa è la dHPLC (denaturing High Pressure Liquid Chromatography) con cui puoi distinguere frammenti anche di 1 sola base, con altissima risoluzione dei picchi. |
 |
|
|
-maddy-
Nuovo Arrivato
Città: cagliari-torino

50 Messaggi |
 Inserito il - 06 agosto 2009 : 21:16:28 Inserito il - 06 agosto 2009 : 21:16:28




|
CIAO!potrei dire 1 cavolata...ma mi pare possa esser utile la CSGE (conformation sensitive gel electrophoresis)...ma ripeto, non saprei con certezza, ricordo solo di aver letto tempo fa 1 lavoro dove tra le metodiche utilizzavano proprio questa...allora siccome non la conoscevo avevo fatto 1 ricerca a tal proposito...
TROVI SU PUBMED:
Conformation sensitive gel electrophoresis for simple and accurate detection of mutations: comparison with denaturing gradient gel electrophoresis and nucleotide sequencing.Körkkö J, Annunen S, Pihlajamaa T, Prockop DJ, Ala-Kokko L.
http://www.ncbi.nlm.nih.gov/pubmed/9465076?ordinalpos=111&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSum
mi scuso in anticipo se non ti sarà utile perchè magari non è quello che intendevi dire/cercare...  |
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 06 agosto 2009 : 21:40:44 Inserito il - 06 agosto 2009 : 21:40:44




|
grazie a tutti per le risposte...
dunque...
- gel d'agarosio low melting. cos'è? mi sai dire indicazioni più accurate?
- dHPLC: questa presuppone l'uso di una sonda con cui far ibridare il mio frammento vero? se ottenessi un unico picco sarebbe omozigote, 2 (o meglio 4, 2 sovrapposti) l'eterozigote T15/T18... però dovrei sapere quanto è lunga di suo la sonda, giusto?
- gel poliacrilammide: infatti anche io mi chiedo come sia possibile discriminare per la sequenza a mano (con il metodo sanger) e come invece non sia fattibile (o molto probabile ho capito male io) con questo frammento digerito
Ma aa questo punto, tra l'altro, dato che il frammento è lo stesso per tutti, sarebbe davvero necessario tagliare con l'enzima? o basterebbe valutare l'amplimero che avrebbe +3bp nel caso del T18....
uff maledetto sequenziatore che non legge bene e mi mette anche 20-25 T (o maledetta sequenasi!) |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 06 agosto 2009 : 23:43:52 Inserito il - 06 agosto 2009 : 23:43:52





|
Sinceramente mi sembra che il metodo più semplice, veloce e fattibile sia il gel di poliacrilamide. L'agarosio low melting è semplicemente un agarosio che si scioglie a T inferiore.
Non ho capito i tui dubbi sul gel di poliacrilamide, semplicemente fai correre i tuoi frammenti sul gel e migreranno in base al PM, hai un potere di risoluzione migliore rispetto ai gel di Agarosio e quindi puoi discriminare anche per poche bp.
Citazione:
Ma aa questo punto, tra l'altro, dato che il frammento è lo stesso per tutti, sarebbe davvero necessario tagliare con l'enzima? o basterebbe valutare l'amplimero che avrebbe +3bp nel caso del T18....
puoi metterlo tutto (quanto è grande?), comunque discrimini in base al PM quello con le 3 basi in più o in meno. |
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 07 agosto 2009 : 02:32:41 Inserito il - 07 agosto 2009 : 02:32:41




|
Citazione:
Messaggio inserito da GFPina
Sinceramente mi sembra che il metodo più semplice, veloce e fattibile sia il gel di poliacrilamide. L'agarosio low melting è semplicemente un agarosio che si scioglie a T inferiore.
e in base a cosa la differente temperatura di fusione sarebbe utile a discriminare bande che differiscono per 3bp?
Citazione:
Non ho capito i tui dubbi sul gel di poliacrilamide, semplicemente fai correre i tuoi frammenti sul gel e migreranno in base al PM, hai un potere di risoluzione migliore rispetto ai gel di Agarosio e quindi puoi discriminare anche per poche bp.
Citazione:
Ma aa questo punto, tra l'altro, dato che il frammento è lo stesso per tutti, sarebbe davvero necessario tagliare con l'enzima? o basterebbe valutare l'amplimero che avrebbe +3bp nel caso del T18....
puoi metterlo tutto (quanto è grande?), comunque discrimini in base al PM quello con le 3 basi in più o in meno.
sono 929 bp (contando i primer)...
il fatto è che non ho mai usato un gel di poliacrilammide se non per elettroforesi di proteine (IEF e AUT-PAGE) per cui non so se riesca a risolvere queste 3 bp di differenza.... a che percentuale dovrei farlo? l'EtBr è messo in soluzione dentro il gel o per visualizzare le bande si usano altri metodi? quanto durerebbe una corsa per il mio caso?
chiedo a voi perchè in questo momento sto valutando le varie possibilità, non potendo discutere con i dottori che mi seguono visto che ora siamo tutti in vacanza :P però voglio cavarne piedi e arrivare preparato a settembre :) |
 |
|
|
Dionysos
Moderatore
  

Città: Heidelberg

1913 Messaggi |
 Inserito il - 07 agosto 2009 : 10:54:01 Inserito il - 07 agosto 2009 : 10:54:01





|
Citazione:
e in base a cosa la differente temperatura di fusione sarebbe utile a discriminare bande che differiscono per 3bp?
In base al fatto che se provi a colare un gel di agarosio con una percentuale
superiore al 4% è probabile che questo si sciolga poco e male e che venga fuori
un gel irregolare, che corre male. Se invece usi il low melting non hai di questi
problemi e puoi fare gel sufficientemente concentrati per separare 'pesci piccoli'
Certamente è inferiore al gel di poliacrilamide, ma sicuramente più rapido da preparare |
Volere libera : questa é la vera dottrina della volontà e della libertà
(F.W. Nietzsche)
Less Jim Morrison, more Sean Morrison!
|
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 07 agosto 2009 : 13:19:33 Inserito il - 07 agosto 2009 : 13:19:33




|
Citazione:
Messaggio inserito da Dionysos
Citazione:
e in base a cosa la differente temperatura di fusione sarebbe utile a discriminare bande che differiscono per 3bp?
In base al fatto che se provi a colare un gel di agarosio con una percentuale
superiore al 4% è probabile che questo si sciolga poco e male e che venga fuori
un gel irregolare, che corre male. Se invece usi il low melting non hai di questi
problemi e puoi fare gel sufficientemente concentrati per separare 'pesci piccoli'
Certamente è inferiore al gel di poliacrilamide, ma sicuramente più rapido da preparare
ho capito sei stato chiarissimo.
e con questo agarosio è possibile separare 3-2bp o sarebbe comunque difficile? ma soprattutto... costa molto di più? :P |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 07 agosto 2009 : 15:14:53 Inserito il - 07 agosto 2009 : 15:14:53





|
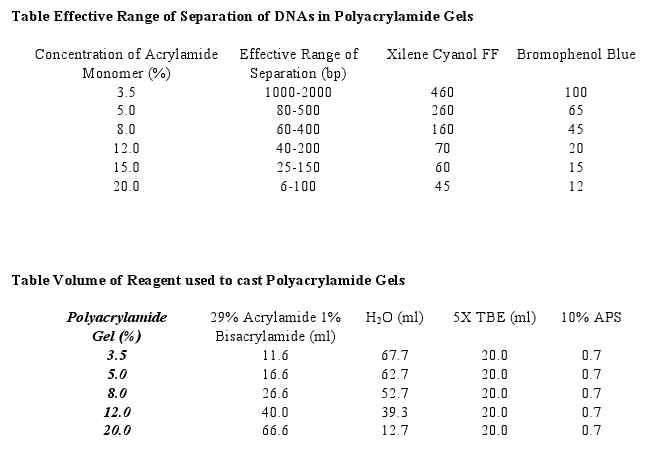
Scusa sono un po' di fretta, ti mette la tabella su come preparare il gel di polyaclimadide, e il range di separazione.
Se hai già tutto per il gel di proteine non ci metti molto.
E' meglio utilizzare Acrylamide:Bisacrylamide diverse da 29:1, ma se hai quella per le proteine 37.5:1, va bene lo stesso, basta che ti fai i calcoli per avere la % corretta di acrylamide, stai attento però che la mobilità sarà leggermente differente.
Insomma in questo caso forse devi fare qualche prova.
Fai migrare il gel molto lentamente.
La colorazione del gel si fa dopo con una soluzione di etidio (la stessa che si può fare per i gel di Agarosio)
TEMED: 0,05ml |
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 07 agosto 2009 : 19:40:35 Inserito il - 07 agosto 2009 : 19:40:35




|
| grazie per la tabella. al 20% separa minimo 6bp.... non basta purtroppo.... :( |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 08 agosto 2009 : 13:06:42 Inserito il - 08 agosto 2009 : 13:06:42





|
Citazione:
Messaggio inserito da Sandrus86
grazie per la tabella. al 20% separa minimo 6bp.... non basta purtroppo.... :(
Beh spero che il frammento che devi far migrare sia più di 6bp, no?
Quella tabella ti dice semplicemente la lunghezza dei frammenti massimo e minimo che puoi far migrare quindi:
20% 6-100
vuol dire che i frammenti da 100bp saranno in cima al gel (assieme a quelli di PM maggiore) mentre in fondo al gel hai frammenti attorno a 6bp, in mezzo tutti gli altri.
Nel tuo caso il frammento era "929 bp" (a quanto hai detto tu), quindi devi utilizzare un gel a percentuale molto inferiore, altrimenti entrambi i frammenti che vuoi discriminare (929 e 926 o 929 e 932?) ti rimarranno tutti impaccati in alto e non vedi nessuna differenza!
Comunque se è sui 900 è più difficile discriminare (con frammenti più piccoli sarebbe meglio).
Puoi anche fare la prova che dicevi tagliando con l'enzima di restrizione e analizzando i frammenti più piccoli.
EDIT: avevo dimenticato nella tabella il TEMED, ovviamente ci vuole altrimenti non polimerizza! Ora l'ho aggiunto sotto. |
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 08 agosto 2009 : 18:50:25 Inserito il - 08 agosto 2009 : 18:50:25




|
Allora ho cercato di fare delle immagini per farvi capire...

questo è il frammento di DNA che sottoporrei al taglio. 929 bp, con il primo taglio corrispondente al sito di restrizione successivo al T18 (tutti i grafici son fatti col t18).
e questa è un'elettroforesi schematizzata al pc

Ora come puoi vedere il frammento che ci interessa è il secondo, che si muoverebbe un po' più veloce nel caso del t15. io devo discriminare questa differenza... riuscire a capire se sia un T15-T15, T18-T18 o un T15-T18...
inoltre visto che i t15 e 18 sono i più frequenti, sarebbe ottimo riuscire anche a discriminare un eventuale T14 o T16 (lo so diventa utopistico :P)....
Sono riuscito a spiegare il problema? |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 08 agosto 2009 : 22:07:40 Inserito il - 08 agosto 2009 : 22:07:40





|
Si ma il problema era chiarissimo!
Mi mancava solo di sapere quanto era la grandezza della banda che devi discriminare, ora lo so 270bp.
A questo punto se hai T18 la banda sarà 270 e se hai T15 sarà 267.
Io proverei con un gel attorno all'8% (60-400bp), in mezzo (più o meno) avrai la banda che devi discriminare.
Riprendendo dal tuoi schema otterrai una cosa del genere:
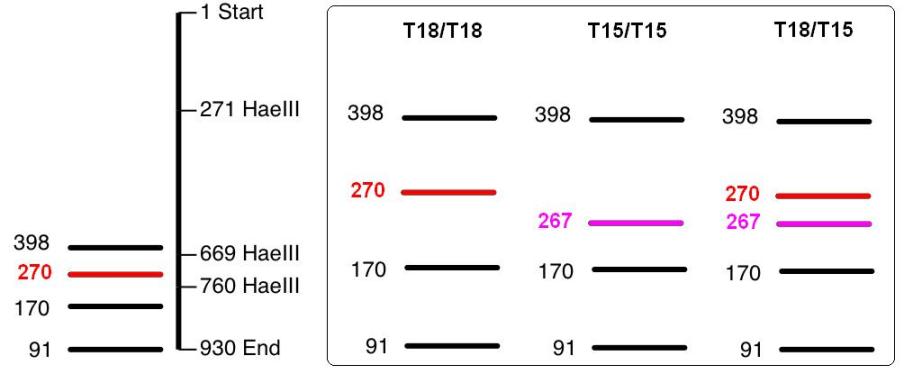
Non è detto che funzioni tutto la prima volta!
Dovrai mettere a punto un po' di condizioni, ma fai una prima prova partendo con un gel 8% e vedi com'è la risoluzione al massimo aumenti o diminuisci la % di acrilamide (è più verosimile che dovrai aumentarla, ma devi vedere tu dai risultati).
Spero tu abbia dei controlli! Sarebbe molto più facile mettere a punto il tutto!
Se riesci a giocare bene con le % del gel puoi anche riuscire a discriminare T14 e T16, non è impossibile, solo devi mettere a punto la cosa.
Altra cosa che puoi fare è comprati un marker adeguato (non so dovresti cercare un po') e metterlo a punto utilizzando il marker per vedere com'è la migrazione alle varie %.
|
 |
|
|
Sandrus86
Nuovo Arrivato

30 Messaggi |
 Inserito il - 09 agosto 2009 : 17:43:01 Inserito il - 09 agosto 2009 : 17:43:01




|
Citazione:
Messaggio inserito da GFPina
Si ma il problema era chiarissimo!
Mi mancava solo di sapere quanto era la grandezza della banda che devi discriminare, ora lo so 270bp.
A questo punto se hai T18 la banda sarà 270 e se hai T15 sarà 267.
Io proverei con un gel attorno all'8% (60-400bp), in mezzo (più o meno) avrai la banda che devi discriminare.
Riprendendo dal tuoi schema otterrai una cosa del genere:
---
Non è detto che funzioni tutto la prima volta!
Dovrai mettere a punto un po' di condizioni, ma fai una prima prova partendo con un gel 8% e vedi com'è la risoluzione al massimo aumenti o diminuisci la % di acrilamide (è più verosimile che dovrai aumentarla, ma devi vedere tu dai risultati).
Spero tu abbia dei controlli! Sarebbe molto più facile mettere a punto il tutto!
Se riesci a giocare bene con le % del gel puoi anche riuscire a discriminare T14 e T16, non è impossibile, solo devi mettere a punto la cosa.
Altra cosa che puoi fare è comprati un marker adeguato (non so dovresti cercare un po') e metterlo a punto utilizzando il marker per vedere com'è la migrazione alle varie %.
mitica!!! :) quando torno in laboratorio propongo il tutto... quindi mi dici che si dovrebbero discriminare bene eventuali t14 e t16 (sarebbero leggermente sotto i classici 15 e 16 e a quel punto si tratterebbe di analizzarli diversamente...
ad ogni modo, come hai fatto a fare quella cosa con Ape :D mi piace :P e se questo esperimento funziona potrei farne una ad hoc e usarla nella tesi :P |
 |
|
| |
Discussione |
|







