| Autore |
Discussione |
|
|
atreliu
Amministratore
  

Prov.: Milano
Città: Milano

2484 Messaggi |
 Inserito il - 28 ottobre 2014 : 11:11:28 Inserito il - 28 ottobre 2014 : 11:11:28







|
Calendario dei Ricercatori 2015:
Crealo con le tue foto!

Riparte per la nona edizione la realizzazione del calendario 2015 con cui ricercatori e laboratori possono trasmettere la curiosità e l'entusiasmo per la ricerca
Tema:
Scopo del calendario è di favorire la divulgazione scientifica: far conoscere la bellezza della Scienza e far condividere la passione per l'attività di Ricerca.
Alcuni esempi di contributi possono essere:
- foto della vita in laboratorio ed esperimenti (colture cellulari, esperimenti di microscopia, elettroforesi, etc);
- creazioni ed elaborazioni digitali anche prodotte con programmi di visualizzazioni molecolare o di grafica 3D (Virtual Modeling, Docking, etc)
Partecipazione:
Chiunque può partecipare al calendario previa iscrizione al sito. Ciascun utente per partecipare dovrà:
- Caricare fino ad un massimo di 3 lavori aventi almeno 800px di risoluzione (larghezza), meglio oltre i 1400px
- Per ciascun contributo dovrà specificare un titolo, una descrizione con indicato il soggetto della foto, perché è interessante, la tecnica che è stata usata per evidenziarlo ed eventuali malattie o meccanismi biologici correlati.
Per caricare i propri lavori utilizzate l'interfaccia nella sezione apposita.
Tempistiche e scadenze:
Termine ultimo per l'invio di materiale per la partecipazione del corso è il 16 Novembre 2014 alle 23.59.59.

Carica le tue foto:
Metti in mostra la tua passione!
|
MolecularLab.it - Animazioni, News, didattica & Community su bioinformatica, biologia molecolare ed ingegneria genetica.
BUONE REGOLE DEL FORUM:
- Prima di postare qualunque cosa leggere il Regolamento!
- Hai provato a cercare prima di postare il tuo problema? |
|
|
|
|
jasonfweb
Nuovo Arrivato

0 Messaggi |
 Inserito il - 27 ottobre 2014 : 13:23:59 Inserito il - 27 ottobre 2014 : 13:23:59


|

Estrazione del DNA
Ingredienti per l'estrazione del DNA dalle fragole. E' una delle semplici dimostrazioni che la nostra associazione Open Wet Lab offre al pubblico del MUSE a Trento
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
jasonfweb
Nuovo Arrivato

0 Messaggi |
 Inserito il - 27 ottobre 2014 : 13:29:22 Inserito il - 27 ottobre 2014 : 13:29:22


|
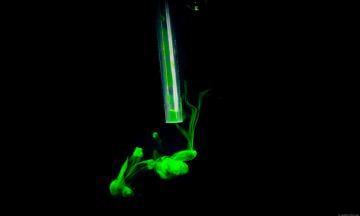
Calceina
Fluorescent dye che usiamo per misurare la permeabilità di liposomi a molecole esterne. La fluorescenza e il colorito giallo verde aumentano con la diluizione, quindi se aggiunta goccia a goccia in acqua da questo meraviglioso effetto.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
jasonfweb
Nuovo Arrivato

0 Messaggi |
 Inserito il - 27 ottobre 2014 : 13:32:19 Inserito il - 27 ottobre 2014 : 13:32:19


|

Proteine fluorescenti
Diverse concentrazioni di proteine fluorescenti
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Leobiotech
Nuovo Arrivato

1 Messaggi |
 Inserito il - 31 ottobre 2014 : 19:34:47 Inserito il - 31 ottobre 2014 : 19:34:47



|
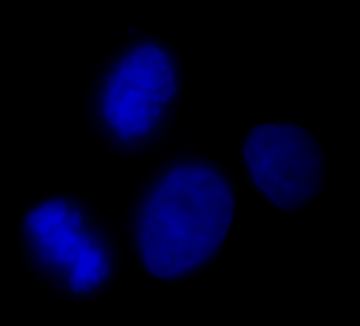
Cycling
DAPI staining in cellule HepG2
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Leobiotech
Nuovo Arrivato

1 Messaggi |
 Inserito il - 31 ottobre 2014 : 19:36:55 Inserito il - 31 ottobre 2014 : 19:36:55



|
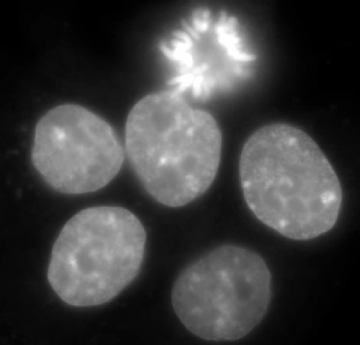
Fuochi d'artificio in vitro!
DAPI staining in cellule HepG2, osservazione della morfologia nucleare
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Leobiotech
Nuovo Arrivato

1 Messaggi |
 Inserito il - 31 ottobre 2014 : 19:44:00 Inserito il - 31 ottobre 2014 : 19:44:00



|
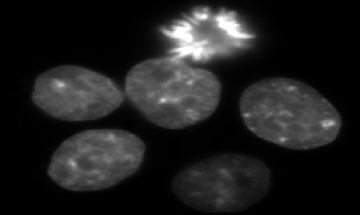
Fuochi d'artificio in vitro!
DAPI staining in cellule HepG2, osservazione della morfologia nucleare
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
MRita
Nuovo Arrivato
Prov.: Trapani
Città: Marsala

1 Messaggi |
 Inserito il - 05 novembre 2014 : 12:14:57 Inserito il - 05 novembre 2014 : 12:14:57



|

Inject your neurotrasmitter!
Iniezione di un campione di purificato proteico per caratterizzare il neurotrasmettitore acido-gamma-aminobutirrico (GABA) mediante HPLC.
Il GABA è stato ottenuto come proteina ricombinante a partire dal gene derivante dal Photobacterium damselae subsp. piscicida, clonato in pET45.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
cidsmoke
Utente Junior


534 Messaggi |
 Inserito il - 06 novembre 2014 : 22:36:29 Inserito il - 06 novembre 2014 : 22:36:29



|

Green fluorescent protein (GFP)
Green fluorescent protein (GFP) visualizzata con UCSF CHIMERA. Particolare sulla triade responsabile dell'emissione di fluorescenza. Utilizzata come marker in molti tipi di esperimenti.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
stefano bacci
Nuovo Arrivato

0 Messaggi |
 Inserito il - 10 novembre 2014 : 10:52:41 Inserito il - 10 novembre 2014 : 10:52:41



|
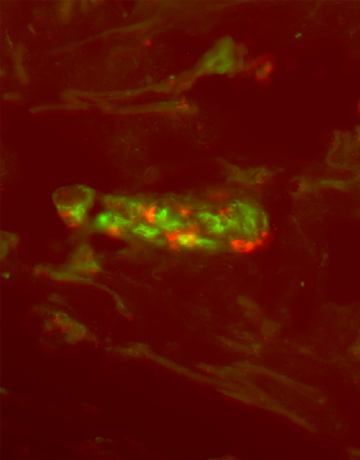
Mastociti e cellule dendriche
Mastociti e cellule dendritiche, citochimica di affinità e immunofluorescenza indiretta, ferite acute
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
gigim
Nuovo Arrivato

6 Messaggi |
 Inserito il - 10 novembre 2014 : 12:40:47 Inserito il - 10 novembre 2014 : 12:40:47



|

Blue waves
Dissolving odf 5 times concentrate laemmli buffer
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
gigim
Nuovo Arrivato

6 Messaggi |
 Inserito il - 10 novembre 2014 : 12:41:36 Inserito il - 10 novembre 2014 : 12:41:36



|

Gerard at work
Gerard using the microtome
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
gigim
Nuovo Arrivato

6 Messaggi |
 Inserito il - 10 novembre 2014 : 12:48:13 Inserito il - 10 novembre 2014 : 12:48:13



|

Panc Fish
Fluorescence image of Pancreatic cancer (Panc-1) cell line after Nano-curcumin treatment (autofluorescent in the green spectrum)
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Muckilla
Nuovo Arrivato

0 Messaggi |
 Inserito il - 11 novembre 2014 : 07:48:05 Inserito il - 11 novembre 2014 : 07:48:05



|
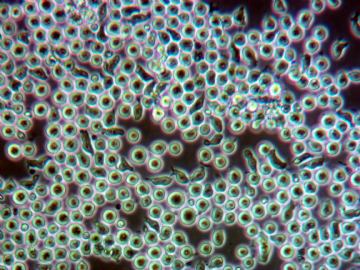
Proliferazione Staminale
Osservazione al Microscopio Ottico di cellule staminali ematopoietiche CD34+ isolate da sangue periferico. E' possibile notare alcune cellule durante la divisione.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
fulvio_barbaro
Nuovo Arrivato

0 Messaggi |
 Inserito il - 11 novembre 2014 : 14:59:59 Inserito il - 11 novembre 2014 : 14:59:59


|
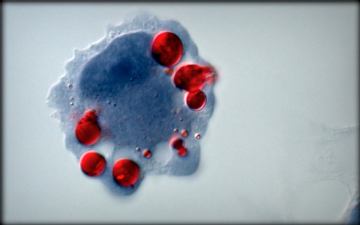
Il mio Rosso Grasso Differenziamento Adiposo
oil-red-oil staining
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
giulipsc
Nuovo Arrivato

0 Messaggi |
 Inserito il - 11 novembre 2014 : 15:12:07 Inserito il - 11 novembre 2014 : 15:12:07


|

Misura dell’acidità di superficiale di due catalizzatori con il metodo di Benesi.
Il metodo di Benesi consiste nella titolazione dei siti acidi del catalizzatore solido, sospeso in un solvente aprotico. Come nelle più tradizionali titolazioni in soluzione, si utilizza una soluzione basica a titolo esattamente noto come titolante.
Il punto di equivalenza è rivelato dal viraggio di un indicatore. L’indicatore è una base debole che si adsorbe sui siti acidi del catalizzatore sufficientemente forti. Perché una molecola basica di indicatore possa interagire con un sito acido, trasformandosi nel corrispondente acido coniugato, è infatti necessario che il sito catalitico abbia una forza maggiore di quella dell’acido coniugato dell’indicatore stesso. Quando si aggiunge la soluzione titolante, la base utilizzata (più forte dell’indicatore) interagisce con i siti acidi. Quando tutti i siti acidi con forza superiore alla pKa dell’indicatore sono occupati dalle molecole di titolante, l’indicatore viene liberato nella sua forma basica e si assiste al viraggio.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
giulipsc
Nuovo Arrivato

0 Messaggi |
 Inserito il - 11 novembre 2014 : 15:26:36 Inserito il - 11 novembre 2014 : 15:26:36


|

Monostrato auto-assemblato di alchilossani su vetro.
Un monostrato auto-assemblato o, secondo l'acronino anglosassone, SAM (Self-Assembled Monolayer), è uno strato organizzato di molecole anfifiliche in cui una delle estremità della molecola, il “gruppo di testa” (head group), mostra una speciale affinità per un substrato. I SAM sono costituiti anche da una coda (tail) a cui può essere legato un gruppo funzionale nella parte finale. Ciascuna di queste molecole è costituita da tre parti principali: la testa del gruppo che viene chemiassorbita sulla superfice di un supporto solido; la catena alchilica, costituita da una lunga catena normal alcano; il gruppo terminale, il gruppo funzionale più semplice è un gruppo metilico ma possono essere composti da gruppi differenti (es. NH2, OH, COOH, …). Il vetro è un possibile substrato per i SAM. E' un materiale solido amorfo formatosi per progressiva solidificazione di un liquido viscoso, ottenuto per fusione di minerali cristallini: inattaccabile e del tutto inerte, trasparente, sopporta alte temperature, facilmente recuperabile e riutilizzabile. I monostrati auto-assemblati (SAM) vengono creati tramite il chemioassorbimento di “gruppi di testa” idrofili sopra un substrato dalla fase sia di vapore che liquida seguita da una lenta organizzazione bi-dimensionale di “gruppi terminali” idrofobici. La natura in cui i gruppi di coda si auto-organizzano in un monostrato rettilineo ordinato dipende dall'attrazione inter-molecolare, o forze di Van der Waals, tra i gruppi alchilici e quelli di coda. Inizialmente, le molecole di adsorbato formano una massa disordinata di molecole, e per un certo periodo di ore, cominciano a formare strutture cristalline o semicristalline sulla superficie del substrato. I “gruppi di testa” idrofili si assemblano insieme sul substrato, mentre i gruppi di coda idrofobici si aggregano lontano dal substrato. Le aree di molecole impacchettate compatte si raccolgono nel nucleo e crescono fino a che la superficie del substrato non si copra di un unico monostrato.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Mitril
Nuovo Arrivato

0 Messaggi |
 Inserito il - 11 novembre 2014 : 23:24:57 Inserito il - 11 novembre 2014 : 23:24:57


|

Quadrifoglio di Muffa
Muffa cresciuta spontaneamente in una beuta di LB broth per coltura batterica.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Floriana A
Nuovo Arrivato

0 Messaggi |
 Inserito il - 12 novembre 2014 : 07:30:35 Inserito il - 12 novembre 2014 : 07:30:35


|
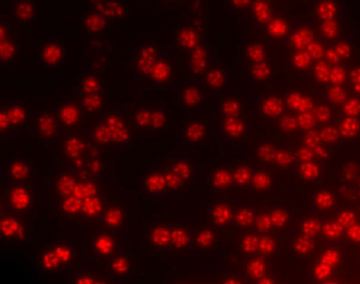
Polyhydroxyalkanoates (PHA):the future green materials of choice
Granuli intracellulari di poliidrossialcanoati (PHA)evidenziati con la colorazione Nile Blue
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Simonbis85
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 00:11:04 Inserito il - 13 novembre 2014 : 00:11:04


|
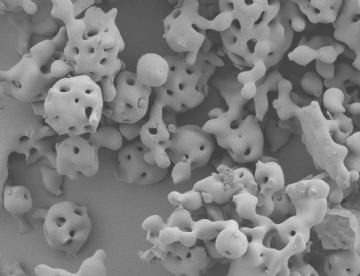
I cereali di un ricercatore
particelle di alfa-tricalcio fosfato (alfa-TCP) viste al microscopio elettronico a scansione (SEM) con ingrandimento X1000.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
dory424
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 10:23:37 Inserito il - 13 novembre 2014 : 10:23:37


|
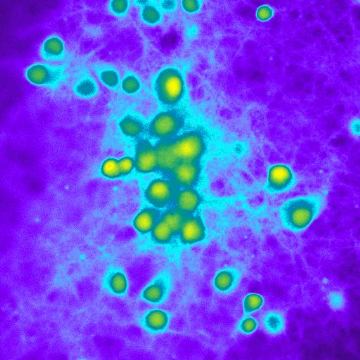
Neuroni in fluorescenza
Neuroni corticali murini caricati con un probe indicatore del pH citosolico e visti con il microscopio a fluorescenza con l'obiettivo 40X.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
testecoeur
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 18:10:09 Inserito il - 13 novembre 2014 : 18:10:09


|
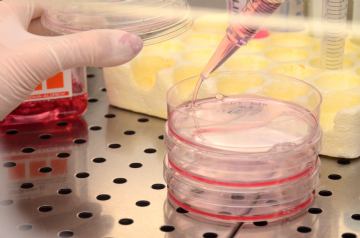
Ora di pranzo
Cambio di terreno a colture di linee cellulari di neuroblastoma
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
testecoeur
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 18:26:03 Inserito il - 13 novembre 2014 : 18:26:03


|

Nessuna Privacy
Osservazione al microscopio a contrasto di fase di cellule di neuroblastoma in coltura
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
testecoeur
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 18:41:19 Inserito il - 13 novembre 2014 : 18:41:19


|

High Voltage
Fase di trasferimento in ghiaccio di un Western Blot
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Vane_R
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 20:19:44 Inserito il - 13 novembre 2014 : 20:19:44


|
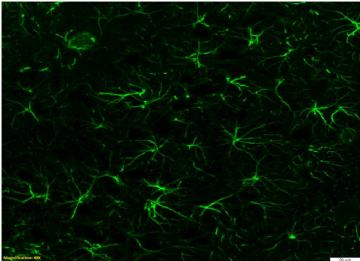
Astrociti visti al confocale
L'immagine mostra gli astrociti presenti a livello ippocampale in una sezione di cervello normale di ratto, rilevati mediante tecnica di immunofluorescenza con marker astrocitario GFAP (glial fibrillary acid protein).
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
PluriPaola
Nuovo Arrivato

0 Messaggi |
 Inserito il - 13 novembre 2014 : 23:22:30 Inserito il - 13 novembre 2014 : 23:22:30


|

Cappa by night
La cappa sterile è illuminata dalla lampada uv.
Partecipa al calendario 2015: metti in mostra la tua passione!
Le tue foto faranno parte del ottavo calendario organizzato da MolecularLab.it |
 |
|
|
Discussione |
|























