| Autore |
Discussione |
|
|
SpaziO InfinitO
Nuovo Arrivato
Prov.: TO
Città: Torino

49 Messaggi |
 Inserito il - 30 novembre 2014 : 11:58:43 Inserito il - 30 novembre 2014 : 11:58:43




|
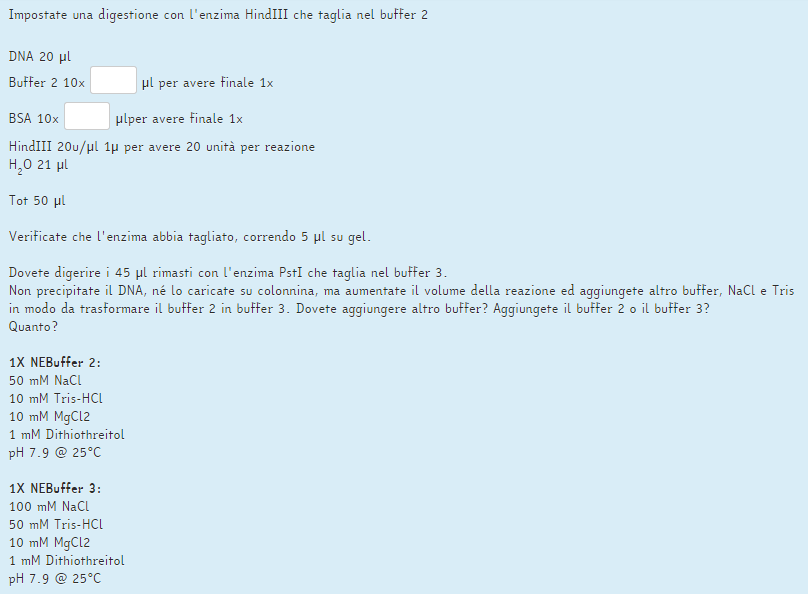
Devo completare questo esercizio ma non so da dove partire, potreste spiegarmi i procedimenti? GRAZIE!
Immagine:
69,04 KB
Immagine:
64,45 KB
Immagine:
50,27 KB
|
|
|
|
|
Giuliano652
Moderatore
   

Prov.: Brescia

6942 Messaggi |
|
|
SpaziO InfinitO
Nuovo Arrivato
Prov.: TO
Città: Torino

49 Messaggi |
 Inserito il - 30 novembre 2014 : 15:09:57 Inserito il - 30 novembre 2014 : 15:09:57




|
Vorrei capire perchè non le me le fa vedere! ho allegato i file e caricati. Il formato è png e dovrebbe leggerlo.
Copio il link di dropbox dove ho caricato le immagini. Spero qualcuno mi possa aiutare. Grazie!!! Grazie anche a te Giuliano652 per i link :D
https://www.dropbox.com/sh/o0ox4ce3xnnrhis/AABoomhZYQTlADyItHZqx_Ota?dl=0 |
 |
|
|
GFPina
Moderatore
    

Città: Milano

8408 Messaggi |
 Inserito il - 01 dicembre 2014 : 23:31:44 Inserito il - 01 dicembre 2014 : 23:31:44





|
Ho sistemato le immagini, ora si vedono! Il problema era nel nome che contiene delle parentesi che non vengono decodificate nel forum.
|
 |
|
|
SpaziO InfinitO
Nuovo Arrivato
Prov.: TO
Città: Torino

49 Messaggi |
 Inserito il - 01 dicembre 2014 : 23:59:38 Inserito il - 01 dicembre 2014 : 23:59:38




|
Citazione:
Messaggio inserito da GFPina
Ho sistemato le immagini, ora si vedono! Il problema era nel nome che contiene delle parentesi che non vengono decodificate nel forum.
Grazieeeeee!!!!! |
Il sapere non viene da solo, bisogna ricercarlo. |
 |
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 02 dicembre 2014 : 16:52:55 Inserito il - 02 dicembre 2014 : 16:52:55




|
 Scritto da MolecularLab Mobile Scritto da MolecularLab Mobile
Partiamo dalla prima immagine?
Hai a disposizione sia il buffer 2 che la BSA come soluzioni con una concentrazione che è dieci volte (10x) quella necessaria alla reazione da allestire. Questo vuol dire che dovrai aggiungere alla reazione una certa quantità di questi componenti concentrati (10x) in modo che la loro concentrazione finale in reazione sia quella corretta (ovvero 1x), in modo cioè che vengano diluiti dieci volte. Per calcolare quanti microlitri di buffer e di BSA concentrati dover aggiungere devi decidere (o in qiesto caso conoscere) il volume finale della tua reazione completa, in questo caso 50 microlitri.
Tu come faresti? :) |

|
 |
|
|
SpaziO InfinitO
Nuovo Arrivato
Prov.: TO
Città: Torino

49 Messaggi |
 Inserito il - 02 dicembre 2014 : 18:42:41 Inserito il - 02 dicembre 2014 : 18:42:41




|
Citazione:
Messaggio inserito da Geeko
Partiamo dalla prima immagine?
Hai a disposizione sia il buffer 2 che la BSA come soluzioni con una concentrazione che è dieci volte (10x) quella necessaria alla reazione da allestire. Questo vuol dire che dovrai aggiungere alla reazione una certa quantità di questi componenti concentrati (10x) in modo che la loro concentrazione finale in reazione sia quella corretta (ovvero 1x), in modo cioè che vengano diluiti dieci volte. Per calcolare quanti microlitri di buffer e di BSA concentrati dover aggiungere devi decidere (o in qiesto caso conoscere) il volume finale della tua reazione completa, in questo caso 50 microlitri.
Tu come faresti? :)
dovrei dividere il volume finale (50 microlitri) per il fattore di diluizione che è 10. Quindi 5 microlitri di di Buffer 2 e 5 microlitri di BSA. No? |
Il sapere non viene da solo, bisogna ricercarlo. |
 |
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 05 dicembre 2014 : 20:33:01 Inserito il - 05 dicembre 2014 : 20:33:01




|
Bene, ottimo :)
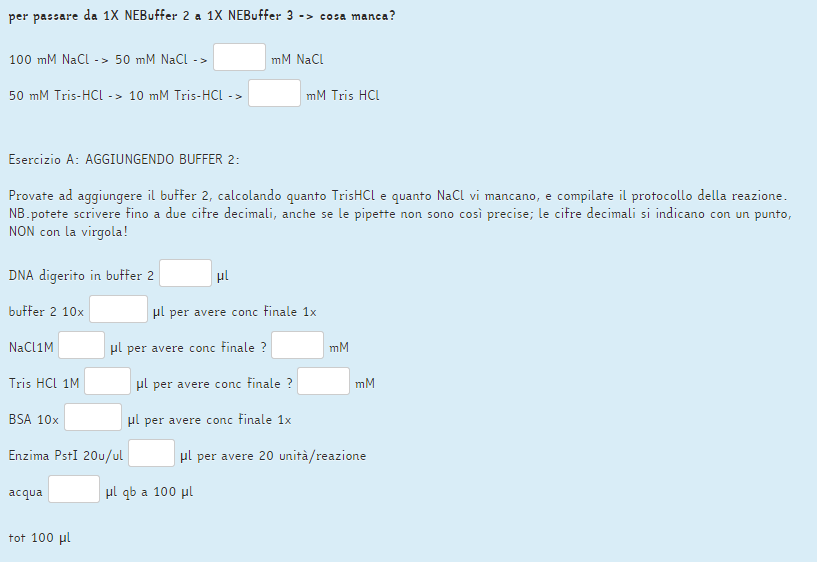
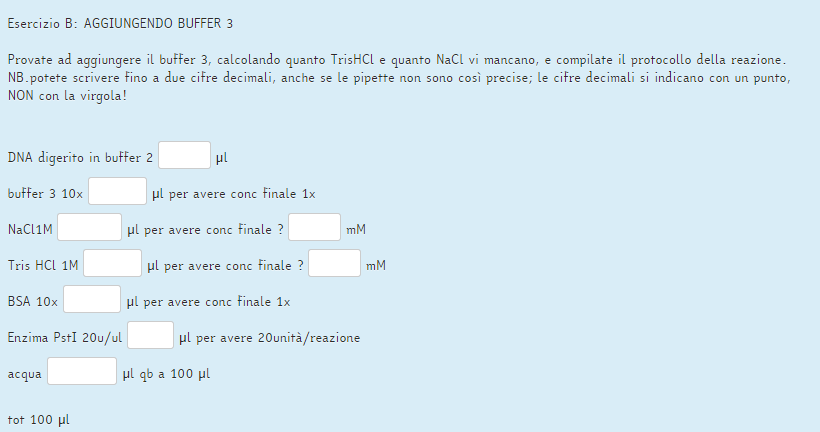
Ora per la seconda parte ti spiego la risoluzione dell'esercizio A, così puoi provare a fare il B.
ESERCIZIO A
Considerando un volume finale di 100 uL e un volume di reazione rimasto di 45 uL dovrai aggiungere un totale di 55 uL alla reazione, di cui 5.5 uL (1/10) saranno di Buffer 2 10x (infatti l'esercizio in questo caso ti indica di aggiungere il Buffer 2).
Calcoliamo quante mmoli avrai nella prima reazione:
50 mmoli : 1000 mL = x mmoli : 0.045 mL
hai 0.00225 mmoli di NaCl nei 45 uL dalla prima reazione.
Ora troviamo quante mmoli di NaCl hai nei 5.5 uL di Buffer 2 (10x) che aggiungerai per assemblare la seconda reazione:
500 mmoli : 1000 mL = x mmoli : 0.0055 mL
hai 0.00275 mmoli di NaCl nei 5.5 uL di Buffer 2, quindi il numero totale di mmoli di NaCl nella reazione finale sarà:
0.00225 mmoli + 0.00275 mmoli = 0.005 mmoli
Queste mmoli in un volume finale di 100 uL darebbero come ti aspetti una concentrazione di 50 mM, appunto quella del Buffer 2.
Ora calcoliamo quante mmoli in più hai bisogno per raggiungere la concentrazione di NaCl del Buffer 3, ovvero 100 mM:
100 mmoli : 1000 mL = x mmoli : 0.1 mL
devo avere 0.01 mmoli in 100 uL di volume finale
mmoli da aggiungere: 0.01 mmoli - 0.005 mmoli = 0.005 mmoli (mancanti)
Calcolo il volume di NaCl 1M stock da aggiungere alla reazione (considerando il volume finale di 100 uL):
1000 mmoli : 1000 mL = 0.005 mmoli : x mL
devo prelevare 0.005 mL di NaCl 1M, ovvero 5 uL, e aggiungerli alla precedente reazione insieme agli altri componenti e
portare il tutto a 100 uL con acqua.
La concentrazione finale di NaCl finale quindi sarà:
Cf = 0.01 mmoli / 0.0001 L = 100 mM NaCl
-----------------------------------------------------------------------------------------------------------------------------
ALTRIMENTI e in maniera moooolto più rapida e semplice calcoli la quantità di NaCl mancante con questo ragionamento:
voglio una concenrazione finale di NaCl (Cf) in reazione di 100 mM, tuttavia ho già una reazione di partenza con 50 mM NaCl (dal Buffer 2)
quindi tenendo conto di questo calcolo la quantità di NaCl 1 M da aggiungere considerando come concentrazione finale non 100 mM, ma 50 mM.
Infatti: 50 mM (dalla sol. di partenza) + 50 mM (NaCl aggiunto per la seconda reazione) = 100 mM
Quindi:
Vi = (Vf * Cf) / Ci = (100 uL * 50 mM) / 1000 mM = 5 uL
Come vedi il risultato è lo stesso!
|

|
 |
|
| |
Discussione |
|








