| Autore |
Discussione |
|
|
Sun89
Nuovo Arrivato

62 Messaggi |
 Inserito il - 23 settembre 2011 : 10:56:36 Inserito il - 23 settembre 2011 : 10:56:36




|
Ciao a tutti!
volevo chiedervi come possiamo spiegare questa situazione:
perchè facendo un western blotting, un anticorpo marcato si lega ad una proteina di 40000 Da e ad altre 2 di 13000 Da e 20000Da?
Grazie
|
|
|
|
|
0barra1
Utente Senior
   

Città: Paris, VIIème arrondissement

3847 Messaggi |
 Inserito il - 23 settembre 2011 : 13:00:54 Inserito il - 23 settembre 2011 : 13:00:54




|
La cosa più probabile è che le due proteine a p.m. minore siano frammenti proteolitici della proteina da 40000 Da, che vengono ancora riconosciuti dall'Ab perché conservano l'epitopo.
Un'altra possibilità è che altre proteine condividano lo stesso epitopo.
Poi ci sono altre casistiche, ma il gel elettroforetico è stato effettuato in condizioni denaturanti o non-denaturanti? |
So, forget Jesus. The stars died so that you could be here today.
A Universe From Nothing, Lawrence Krauss
|
 |
|
|
Sun89
Nuovo Arrivato

62 Messaggi |
 Inserito il - 23 settembre 2011 : 14:13:43 Inserito il - 23 settembre 2011 : 14:13:43




|
| è stato fatto un SDS-PAGE, quindi condizioni denaturanti... |
 |
|
|
SpemannOrganizer
Utente
 

Città: Los Angeles

955 Messaggi |
 Inserito il - 23 settembre 2011 : 14:24:04 Inserito il - 23 settembre 2011 : 14:24:04




|
| uhmmm forse isoforme/prodotti di splicing alternativo? |
 |
 |
|
|
Martin.diagnostica
Utente Attivo
  


1582 Messaggi |
 Inserito il - 23 settembre 2011 : 23:39:34 Inserito il - 23 settembre 2011 : 23:39:34




|
Citazione:
La cosa più probabile è che le due proteine a p.m. minore siano frammenti proteolitici della proteina da 40000 Da, che vengono ancora riconosciuti dall'Ab perché conservano l'epitopo.
Se è un monoclonale dovresti avere la certezza di avere un ab che riconosce un unico epitopo, quindi l'ipotesi di obarra1 è verosimile.
Citazione:
Un'altra possibilità è che altre proteine condividano lo stesso epitopo.
Verosimile x un siero policlonale allora l'ab potrebbe essere meno specifico
|
Facebook |
 |
|
|
Martin.diagnostica
Utente Attivo
  


1582 Messaggi |
 Inserito il - 24 settembre 2011 : 00:14:28 Inserito il - 24 settembre 2011 : 00:14:28




|
questa per esempio è una lastra di un ab che feci produrre da una proteina ricombinate purificata da coli in coniglio, il siero dava background e aspecifici quindi prima di utilizzarlo è stato ulteriormente raffinato (riquadro di sinistra)
Immagine:
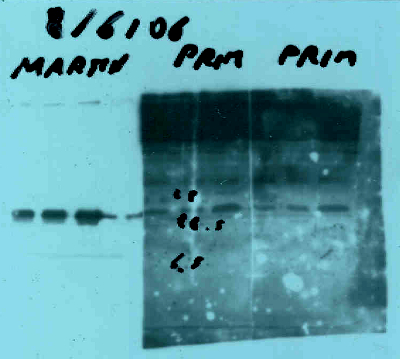
119,55 KB
bei tempi quando ero martin.ricerca :D |
Facebook |
 |
|
| |
Discussione |
|





