Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
Heisenberg0
Nuovo Arrivato

5 Messaggi |
 Inserito il - 04 marzo 2013 : 11:35:33 Inserito il - 04 marzo 2013 : 11:35:33




|
Salve, ho da poco rispolverato biochimica e vorrei chiedere a voi un aiuto su esercizi di questo tipo. L'esercizio è il seguente:
Di seguito è riportata la curva dititolazione di
un amminoacido. Osservando il grafico:
a)stabilire i valori dei pka dell'aminoacido;
b)calcolare il valore del pI e individuarlo sul grafico
c)Indicare quali forme dell'aminoacido sono presenti a maggiore concentrazione a ph 2.2 5,6 e 10,5
a pH2-2,5.6 e L0.5. I
d) Calcolare la carica netta media a pH 10.5.

Il grafico non è quello vero dell'esercizio, ne ho preso uno a caso per far capire che viene fornita la curva di titolazione "vuota" , senza i vari valori scritti.
Quello che vorrei capire è dalla curva di titolazione, senza i vari punti di pka1 pka2 pkr segnati, come faccio a capire se si tratta di un amminoacido acido o basico? Grazie a tutti
|
|
|
|
|
Uther
Nuovo Arrivato

Prov.: Napoli
Città: Na

35 Messaggi |
 Inserito il - 04 marzo 2013 : 18:34:02 Inserito il - 04 marzo 2013 : 18:34:02




|
Le informazioni che ti servono sono tutte estrapolabili dalla curva di titolazione dell'amminoacido in questione.
Posta la curva e lavoriamo su quella =)
Per prima cosa devi avere chiaro in mente cosa stai cercando: pKa, PI, carica netta media ecc.
Come procederesti?
Ut |
 |
|
|
Heisenberg0
Nuovo Arrivato

5 Messaggi |
 Inserito il - 05 marzo 2013 : 00:59:14 Inserito il - 05 marzo 2013 : 00:59:14




|
| Il mio problema è capire come individuare se l'amminoacido sia acido o basico senza che il testo dell'esercizio fornisca i valori di pka1 pka2 e pkaR. Se il testo dell'esercizio fornisce questi valori non ho problemi, calcolo il punto isoelettrico e vedo se l'amminoacido è acido o basico e quindi posso vedere quali forme di aa a determinati pH prevalgono. Ma se questi valori non sono forniti non so come fare per capire se inizialmente l'amminoacido in forma completamente protonata abbia carica +1, poi al primo punto di equivalenza dove ph=pka1 [AA+1] = [AA0], poi al punto isoelettrico prevale la forma zwitterionica, eccetera (quindi sarebbe un amminoacido acido), oppure se inizialmente l'amminoacido completamente protonato è in fomra AA+2, poi al primo punto di semi equivalenza [AA+2]=[AA+1] eccetera (quindi sarebbe un amminoacido basico). Non so se sono riuscito a spiegarmi decentemente. |
 |
|
|
Uther
Nuovo Arrivato

Prov.: Napoli
Città: Na

35 Messaggi |
 Inserito il - 05 marzo 2013 : 18:59:19 Inserito il - 05 marzo 2013 : 18:59:19




|
Chiarissimo.
Torno a ripeterti però che tutte queste informazioni sono estrapolabili dalla curva di titolazione che ti viene fornita con l'esercizio, a maggior ragione se il testo non ti da informazioni su QUALE amminoacido stai considerando.
Ti faccio vedere come puoi tirare fuori una serie di informazioni dalla semplice osservazione della curva. Faccio finta che la curva dell'esercizio sia quella generica che mi hai fornito (che fa letteralmente schifo, quindi procuratene una migliore ;))
a) stabilire i valori di pKa dell'amminoacido
Partiamo da qua.
Osservo il grafico e vedo che in ascissa ci sono gli equivalenti di OH-, deduco che si tratta di una titolazione acido-base fatta aggiungendo un tot di base alla soluzione di partenza che contiene la proteina. Presumo quindi che la situazione di partenza corrisponda ad un largo eccesso di ioni H+ (ambiente acido), quindi tutto quello che è protonabile è protonato. E infatti io parto da un pH che è intorno a 1 quindi acidissimo e man mano che aggiungo base alla soluzione il pH vira verso valori più alti.
Do un'occhiata alla curva: ad occhio vedo che il PI sta più o meno intorno a 11, vedo almeno tre flessi o comunque la curva cambia comportamento diverse volte, potrebbe essere la curva di un amminoacido con tre gruppi protonabili, ok quale?
Lo saprò dire dopo che avrò determinato i pKa. Però qualcosa la posso già osservare. Sicuramente posso escludere gli amminoacidi con catena laterale R non carica (tolgo da mezzo Gly, Leu, Ile, Ala, Pro, Val), gli aromatici (Tyr, Trp, Phe), i polari senza carica (Cys, Ser, Thr)e però poi noto che anche gli amminoacidi con catena laterale acida non fittano bene la curva, perchè se fossero presenti due gruppi acidi il PI me lo aspetterei acido, cioè dovrei avere un eccesso di acidità per sopperire alla dissociazione del secondo gruppo acido (il primo è acidissimo si deprotona appena alzo il pH di pochissimo) e fare in modo che l'amminoacido rimanga neutro.
Bene, si tratta di una curva di un amminoacido con catena laterale positiva (amminoacido basico), e tra l'altro noto che l'ARGININA ha un PI più o meno di 11, molto simile a quello che intuisco dal grafico.
Torno a guardare la curva, mi immagino che per [OH-] < 0,1 l'amminoacido sia completamente protonato quindi tutti e tre i gruppi, il gruppo alfa amminico, il gruppo alfa carbossilico e il gruppo amminico in catena laterale siano protonati. Partiamo quindi da una condizione in cui l'amminoacido ha carica netta +2.
+1 il gruppo alfa-amminico e +1 il gruppo guanidinico (sto supponendo di lavorare con arginina); il carbossile è protonato ma non da carica positiva.
Alzo un poco il pH (sto fornendo un pò di soluzione basica) il pH sale e raggiunge il pKa del primo gruppo. Tra tutti e tre i gruppi che ti ho citato quello sicuramente più acido (cioè che si dissocia prima) è il gruppo carbossilico il cui pKa è parente a 1,8-2. Non appena la concentrazione di ioni H+ aumenta di poco per effetto dell'aggiunta della base, gli ioni H+ rimasti in soluzione non sono più sufficienti a protonare il gruppo carbossilico. Quando il pH = (pKa gruppo COOH) il 50% delle molecole sarà presente nella forma con COOH protonato e il 5o% delle molecole sarà presente nella forma con COOH deprotonato (quindi COO-). Man mano che il pH sale ancora ci saranno sempre meno molecole con COOH protonato. In QUESTO momento del processo la carica netta dell'amminoacido è +1. Ho deprotonato un gruppo carbossilico, "fornito" una carica negativa, la carica totale è quindi +1.
Procedo con la titolazione, il pH sale, finchè non raggiunge il valore di pKa del secondo gruppo protonabile cioè del alfa-NH2. Questo gruppo ha un valore di pKa di 9, è infatti un gruppo basico. In questa condizione analogamente a quella precedente il 50% delle molecole sarà presente con il gruppo NH2 protonato e il restante 50% presenterà il gruppo alfa amminico in forma deprotonata.
Aumento ancora il pH finchè non raggiunge il valore di (circa) 11,5 che corrisponde al PI. In questa condizione la carica netta dell'amminoacido è 0. Questo vuol dire che il gruppo alfa amminico in tutte le molecole è deprotonato, quindi non ho più la carica positiva di questo gruppo, e l'altra carica positiva del gruppo guanidinico in catena laterale è bilanciata dal gruppo carbossilico deprotonato (e quindi carico negativamente).
Questa situazione di sale interno o zwitterione, in cui l'aa ha carica netta zero permane anche se si perturba il pH fornendo altra base; fino a che il pH non raggiunge il valore del pKa del terzo gruppo protonabbile, cioè del gruppo amminico in catena latrale è che è circa 13.
In quella condizione l'amminoacido ha carica netta -1. Ho deprotonato il gruppo amminico che contrastava la carica negativa del gruppo carbossilico.
Facendo un discorso complessivo sulla figura, sono riuscito a rispondere a tutte le domande.
La cosa importante che ti devi ricordare è che alla domanda "in che stato è l'amminoacido X?" deve seguire la seguente domanda "a che pH?!?!!", altrimenti non sei in grado di stabilire la sua carica e quindi il suo comportamento.
In questo caso non avevamo valori di riferimento di pH ne tantomeno di pKa, ma ricordati che nei processi di titolazione (in generale) esiste la Legge di Henderson-hasselbach che ti consente di relazionare pH e pKa di uno specifico oggetto, e che anche per il calcolo del PI c'è una fomrmula.
Ut |
 |
|
|
Heisenberg0
Nuovo Arrivato

5 Messaggi |
 Inserito il - 05 marzo 2013 : 19:48:55 Inserito il - 05 marzo 2013 : 19:48:55




|
Allora, innanzitutto grazie per l'aiuto.
La curva dell'esercizio è per l'esattezza questa
Immagine:
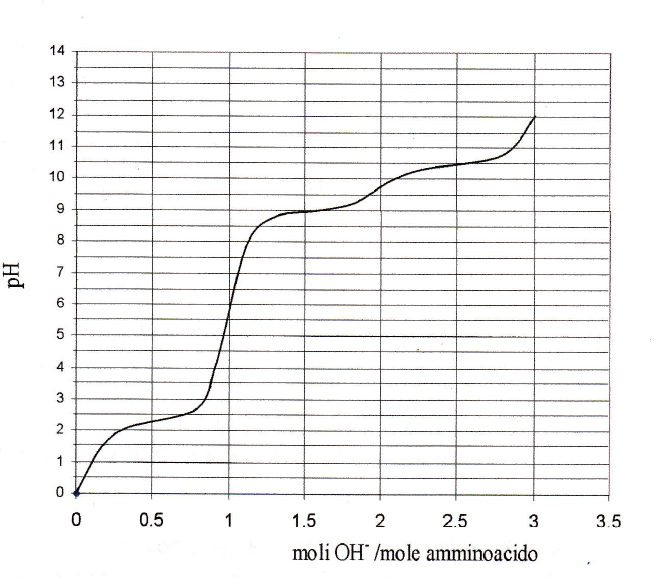
279,48 KB
E ancora non ho capito come capire se l'amminoacido in questione sia basico o acido. E se non lo capisco non riesco ad individuare il punto isoelettrico, perchè non so dove stia la forma zwitterionica (perchè se è acido a pH1 completamente protonato sarà nella forma AA +1, se è basico AA+2). (Non ho capito neanche come individuare a occhio dove stia il pI, dato che senza valori dei pka non posso calcolarlo). L'unica cosa che ho bisogno di capire è se si tratti di un aa acido o basico.
L'esercio svolto è questo
Immagine:
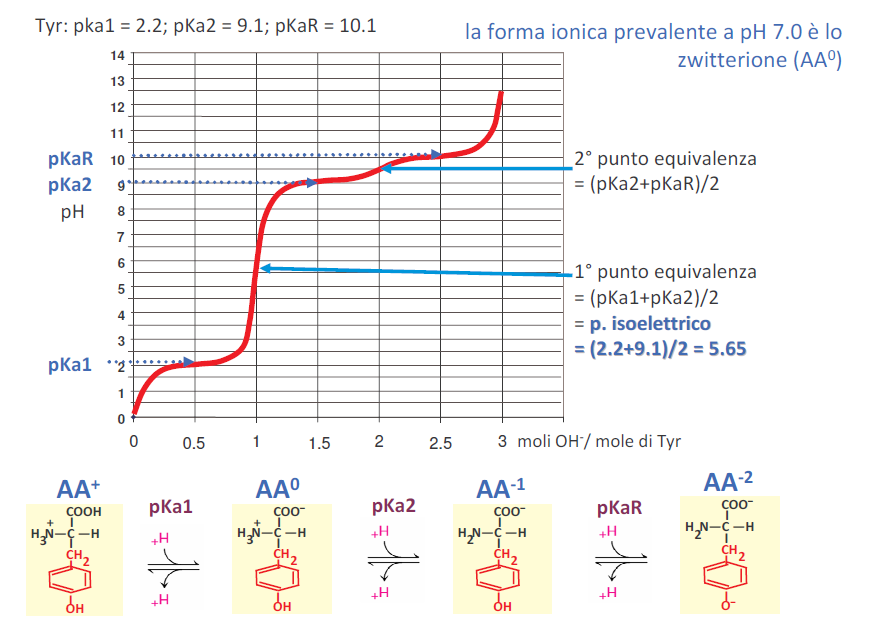
88,94 KB
Ora, io non riesco a capire come individuare se l'amminoacido è acido o basico quindi se a pH1 sia in forma AA+1 o AA+2, senza che i valori dei vari pka (o tantomeno il nome dell'amminoacido) vengano forniti. In questo caso l'amminoacido è della tirosina, ma senza i vari valori non riesco a capire se una determinata curva di qualunque amminoacido si tratti di un amminoacido basico o acido..
ad esempio dell' acido glutammico
Immagine:
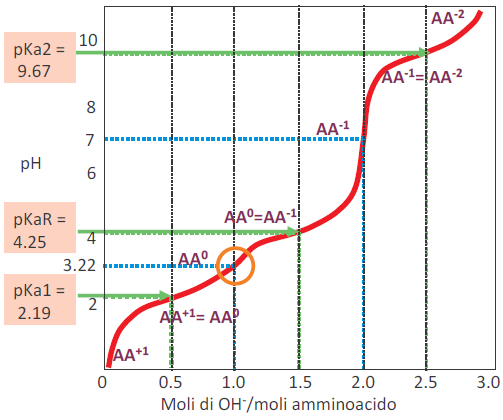
35,79 KB
Facendo finta naturalmente che tutti i dati non ci siano scritti ma ci sia solo la curva, non saprei come capire se sia acido o basico.
Poi magari non si può capirlo se non vengono forniti i valori e bisogna studiarsi i vari pka a memoria. Bo. |
 |
|
|
Uther
Nuovo Arrivato

Prov.: Napoli
Città: Na

35 Messaggi |
 Inserito il - 05 marzo 2013 : 22:23:33 Inserito il - 05 marzo 2013 : 22:23:33




|
Butta un occhio qua e confronta il grafico dell'arginina (amminoacido basico) con quello dell'aspartico (amminoacido acido).
Nota che sono abbastanza diversi; il format del grafico è comunque quello, però il grafico dell'aspartico è molto più "diagonalizzato" rispetto a quello dell'arginina.
Oltre a queste differenze strutturali il discorso lo devi fare sui gruppi funzionali.Amminoacidi basici e amminoacidi acidi hanno DIVERSI GRUPPI FUNZIONALI CHE VENGONO TITOLATI ------ ERGO VEDO COSE DIVERSE.
Amminoacido acido - aspartico - che gruppi ha?
alfa carbossile, gruppo alfa amminico, e un carbonile in catena laterale. Quindi DUE CARBOSSILI. Che pKa hanno in generale? Questi valori li trovi su qualunque tabella, nell'ordine sono: 2.0 - 9.82 - 3.83 (lo so che tu parti dal fatto che non li sai, ti sto spiegando dove stanno messe nel grafico le cose che ti devono interessare)
Ora, come è strutturata una curva di titolazione?
Asse X equivalenti OH-
Asse Y pH
Bene, quindi visto che parto da pH = 0 e da 0 equivalenti di OH- inseriti, parto da ambiente acido, cosa mi aspetto di vedere?!
Mi aspetto di vedere la curva che descrive i tre gruppi, dal più acido al più basico. PER UN AA ACIDO POICHE' HO DUE CARBONILI VEDRO' DUE FLESSI NELLA CURVA, UNO A pH 2 E UNO POCO DISTANTE A pH 3.83. POI VEDRO' UN TERZO FLESSO A 9.82 E TRA QUESTI UN FLESSO CORRISPONDENTE AL PUNTO ISOELETTRICO.
I due carbonili sono MOLTO VICINI SUL GRAFICO perchè sono lo stesso tipo di gruppo (che subisce diversi intorni chimici, ma questa è un'altra storia...)
Amminoacido basico - arginina - che gruppi ha?
gruppo alfa carbossilico, gruppo alfa amminico, gruppo amminico in catena laterale. Valori pKa nell'ordine: 2 - 9 - 13.20
Ho sempre tre parti di curva differenti, ma sono messi a distanza diversa rispetto agli amminoacidi acidi. Se dopo la prima parte di grafico (in basso a sinistra) la successiva parte della curva che ha un comportamento diverso è a molte unità di pH di distanza i due oggetti non SONO LO STESSO TIPO DI GRUPPO.
Punto Isolettrico, come lo vedo?
(In soldoni) è la parte centrale della regione a "esse" sul grafico. Quella regione che corrisponde ad un punto di flesso è la regione in cui si verifica la presenza dello zwitterione. Trovato il centro della zona a esse, ti sposti sull'asse delle Y e vedi a che valore di pH corrisponde.
Facciamo un esempio e sfruttiamo il grafico dell'acido glutammico che hai postato che è molto chiaro. Fai finta di non sapere che si tratti dell'acido glutammico.
Guarda le frecce verdi, fai finta che puntino in verso opposto; ad un flesso sulla curva corrisponde un certo valore di pH. Quel pH è il pKa di un certo gruppo funzionale. Il valore di pH è basso? Anche senza conoscere i pKa dei vari gruppi è intuibile che si tratti di quello di un oggetto acido.
Allora stabilisci che il primo gruppo che hai trovato è acido, potrebbe essere un carbonile. E ti dice anche guarda che in questa situazione AA+1 = AA0 che corrisponde al discorso sul 50% e 50% delle molecole che ti ho fatto prima.
Proseguiamo, trattini blu, che stanno dicendo?
Ti stanno facendo notare che mentre "cammini" sul grafico, cioè mentre fornisci ioni OH- qualcosa cambia, il pH inizia ad aumentare, il secondo gruppo funzionale (la prossima freccia verde) si sta iniziando a deprotonare; e ti mette un indicatore per sottolineare che in quel punto di flesso stai iniziando ad avere SOLO AA0, la condizione di 50% AA+1 e 50%AA0 che avevi prima non ce l'hai più. Perchè? Perchè il pH dell'ambiente sta cambiando.
Seconda freccia verde, pH = circa 4. Ho trovato un altro flesso. Ho trovato un altro gruppo. Il pH è quattro, tipicamente quello di un carbossile della catena laterale. Probabilmente ho a che fare con un aa acido (avessi avuto uno basico NON AVREI VISTO NULLA QUI ADESSO).
Proseguo, altri trattini blu, zona esse del grafico ----Punto isoelettrico!! Te lo chiama AA-1, ma te lo poteva anche chiamare anche Albero, non cambiava niente.
Proseguiamo, altra striscia verde, a che pH sto? Circa dieci, ho trovato un gruppo basico, sarà quasi al 100% il gruppo alfa amminico.Come ci sono arrivato a sto pH 10?! Aggiungendo ioni OH- cioè continuando a titolare.
Ricapitolando, che ho trovato?
Due regioni corrispondenti a due gruppi carbossili, uno molto molto acido (pH = 2) ed uno un pò meno acido (pH = 4) e poi un gruppo amminico (pH = 10), quindi deduco di aver trovato un aa acido. Voglio sapere in dettaglio qual'è? Vado a vedere delle tabelle e confronto i valori di pKa con quelli che ho trovato.
Spero di averti chiarito le idee, fammi sapere se c'è altro.
Ut
|
 |
|
|
Uther
Nuovo Arrivato

Prov.: Napoli
Città: Na

35 Messaggi |
|
|
Heisenberg0
Nuovo Arrivato

5 Messaggi |
 Inserito il - 05 marzo 2013 : 23:51:38 Inserito il - 05 marzo 2013 : 23:51:38




|
| Grazie mille, ho più o meno afferrato il concetto. Ora mi faccio un pò di esercizi. Se non ho capito male due gruppi uguali ( ad esempio il cooh legato al carbonio alfa e il cooh della catena laterale o il gruppo alfa amminico e il gruppo amminico della catena laterale) devono essere relativamente vicini e a ph relativamente vicino. In questi amminoacidi del link che mi hai postato ora me ne rendo conto. L'unica cosa che mi lascia perplesso è la curva della tirosina in cui il gruppo ionizzabile della cattena R ( OH) è molto in alto, quindi seguendo questo metodo guardando il grafico della tirosina avrei detto che 0,5 (in ascissa) corrisponde al gruppo cooh (pka1), poi a 1,5 avrei detto che è un gruppo amminico di catena laterale perchè sta a pH alto ( e invece è il pka2) e il terzo punto, a 2,5 avrei detto che fosse il gruppo alfa amminico e invece è l'OH del gruppo R. Ma per altri amminoacidi acidi o basici con gruppo R cooh o nh3+ ho capito il concetto. Ti ringrazio davvero per l'aiuto. |
 |
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|





