Quanto è utile/interessante questa discussione:
| Autore |
Discussione |
|
|
mars93
Nuovo Arrivato

12 Messaggi |
 Inserito il - 03 luglio 2020 : 17:46:17 Inserito il - 03 luglio 2020 : 17:46:17



|
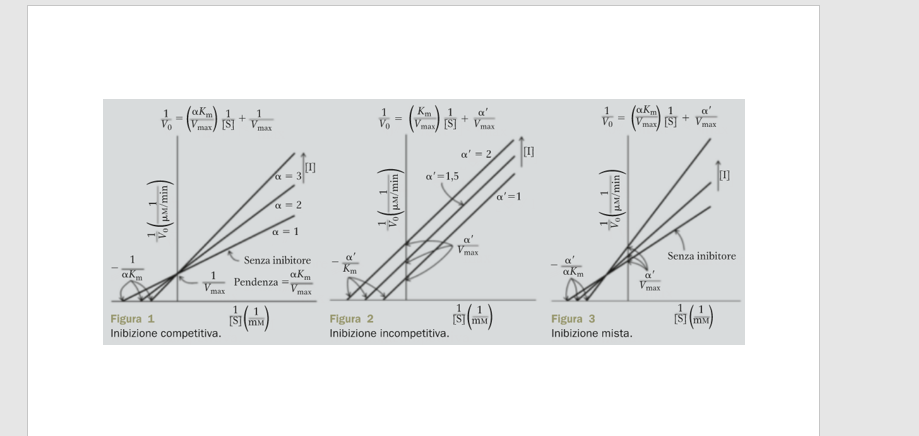
Salve a tutti, avrei bisogno di aiuto per capire i grafici dei doppi reciproci dei vari tipi di inibitori enzimatici riportati in figura. Nel caso degli inibitori competitivi credo di esserci quasi, mentre nel caso degli incompetitivi e dei misti ancora nulla. Provo a spiegarvi fin dove sono riuscito ad arrivare. Nei grafici vengono riportate tre rette che rappresentano l'attività dei vari enzimi in assenza di inibitori e in presenza di concentrazioni crescenti di inibitore. Nel caso di inibitori competitivi si vede facilmente che tutte e tre le rette intercettano l'asse Y nello stesso punto, e quindi questo vuol dire che la Vmax sarà sempre la stessa,sia in assenza che in presenza di inibitore competitivo. La pendenza delle rette però è diversa e queste intercettano l'asse delle X in tre punti diversi, quindi ci sarà una variazione della Km, la quale aumenterà mano mano che aumenterà la concentrazione dell'inibitore competitivo, diminuendo così l'affinità dell'enzima per il substrato. Quindi nel caso di inibitori competitivi aumenta la Km di un fattore pari ad #945; mentre la Vmax sarà la stessa in ogni caso, e inoltre l'inibizione può essere rimossa aumentando la concentrazione del substrato. Ora, a livello teorico ho capito perchè si verifica quanto detto nell'ultimo punto(aumentando il numero di molecole di substrato sarà più facile che si leghino queste al sito attivo dell'enzima piuttosto che l'inibitore) ma a livello grafico da cosa si capisce? Dal fatto che la Vmax non cambia? Invece per le altre due tipologie di grafico brancolo completamente nel buio, e in quello dell'inibizione incompetitiva non capisco quale sia la retta della reazione senza inibitore, visto che non viene indicato. 
Grazie a chiunque proverà ad aiutarmi
Immagine:
93,55 KB
|
|
|
|
| |
Discussione |
|
|
|
Quanto è utile/interessante questa discussione:
| MolecularLab.it |
© 2003-24 MolecularLab.it |
 |
|
|






