| Autore |
Discussione |
|
|
LorenZ
Nuovo Arrivato

95 Messaggi |
 Inserito il - 20 giugno 2011 : 14:01:14 Inserito il - 20 giugno 2011 : 14:01:14




|
Il gruppo carbosilici ed amminici degli amminoacidi hanno un valore di pka diverso rispetto ai valori di pka degli stessi gruppi ( quando non si trovano a far parte degli A.A. ).
Da quanto ho letto sul libro, il motivo per cui i pka ( di questi gruppi ) variano per la presenza di altri gruppi che li influenzano. Prendendo il caso più semplice possibile, cioè la glicina, abbiamo che i valori di pka del gruppo:
carbosilico si attesta intorno a 2.35 ( mentre dovrebbe essere più alto ). Il motivo per cui questo succede è per la presenza del gruppo amminico ( NH3+ ) che stabilizza la forma non protonata ( coo-).
Amminico vale ( + o - ) lo stesso ragionamento fatto sopra.
Ora il mio dubbio, sta nelle motivazioni che il libro propone per spiegare la diminuzione del pka. Se il gruppo amminico stabilizza la forma coo-, sta ad indicare che avremo più [Coo-]. Se fosse così allora non si spiegherebbe perchè il pka dovrebbe diminuire....
Se aumenta la concentrazione di forma de-protonata il rapporto che si fà per ottenere pka ( [forma de-protonata;coo-]/[forma protanata;cooh] ) dovrebbe comunque aumentare... molto più di quanto non aumenterebbe se ci fosse poca presenza di coo-.
Qualcuno può spiegarmi se il mio ragionamento è giusto? e se fosse così mi potete spiegare come mai il pka diminuisce invece d'aumentare ?
|
|
|
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 20 giugno 2011 : 14:27:28 Inserito il - 20 giugno 2011 : 14:27:28




|
No, il ragionamento non torna, perchè non ti basta ragionare sul rapporto che hai riportato tu [H+][COO-]/[COOH] (che altro non è che la Ka di quel gruppo) senza considerare la definizione di pKa:
pKa=-log Ka
ed'è proprio quell'antilogaritmo che fa si che ad un aumento della Ka, segue una diminuzione della relativa pKa. |
 |
|
|
LorenZ
Nuovo Arrivato

95 Messaggi |
 Inserito il - 20 giugno 2011 : 15:42:10 Inserito il - 20 giugno 2011 : 15:42:10




|
Scusa ma non ho capito. Il simbolo meno davanto al logaritmo mi serve per ottenere un valore di pka che altrimenti sarebbe negativo--->questo perchè dal rapporto ottengo un numero con la virgola (visto che il numeratore è più piccolo del denominatore). Ma cmq non toglie che il valore ( come numero assoluto, senza segno) sarà maggiore perchè maggiore sarà il numero di coo- presente a numeratore (sempre secondo il discorso che facevo sopra).
|
 |
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 20 giugno 2011 : 16:03:40 Inserito il - 20 giugno 2011 : 16:03:40




|
Adesso ragioniamo solo dal punto di vista matematico, per come hai introdotto te l'argomento.
La costante di dissociazione acida Ka avrà praticamente sempre un valore compreso tra 0 e 1 visto che stiamo considerando un acido debole, e come hai detto bene tu, il segno meno fa sì che otteniamo un valore positivo di pKa.
Basta che ti ricordi com'è fatta graficamente una funzione logaritmica, e che quando metti il segno meno nella relazione, ottieni un ribaltamento della curva rispetto all'asse delle ascisse:
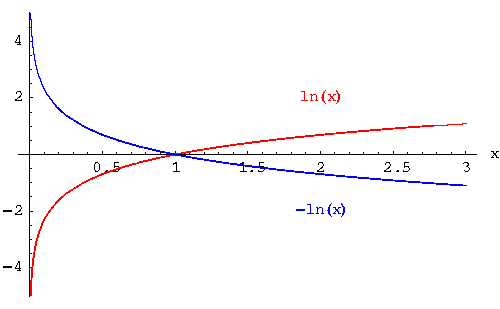
Ora, l'immagine che ho messo ha un logaritmo naturale, e nel nostro caso ne abbiamo uno in base 10, ma le cose non cambiano.
Di tutta la funzione in blu a noi interessa solo la regione di Ka (sull'asse x) compresa tra 0 e 1. Se segui l'andamento della curva, vedi che se aumenta la Ka (e quindi ci saranno più [COO-] come dicevi) allora il valore della pKa diminuisce! |
 |
|
|
LorenZ
Nuovo Arrivato

95 Messaggi |
 Inserito il - 20 giugno 2011 : 19:31:23 Inserito il - 20 giugno 2011 : 19:31:23




|
Finalmente ho capito  . Grazie gekko e complimenti per il grafico ;) . Grazie gekko e complimenti per il grafico ;) |
 |
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 20 giugno 2011 : 20:59:10 Inserito il - 20 giugno 2011 : 20:59:10




|
 Di nulla! Tutto questo era per l'esame di biochimica? Perchè se è così siamo in due a doverlo dare! Di nulla! Tutto questo era per l'esame di biochimica? Perchè se è così siamo in due a doverlo dare!  |
 |
|
|
LorenZ
Nuovo Arrivato

95 Messaggi |
 Inserito il - 20 giugno 2011 : 21:05:35 Inserito il - 20 giugno 2011 : 21:05:35




|
Purtroppo anch'io sto preparando questo mostro d'esame  , se dovessi avere dubbi invia un pm o edita un post che siamo sulla stessa barca! , se dovessi avere dubbi invia un pm o edita un post che siamo sulla stessa barca! |
 |
|
|
Geeko
Utente
 

Città: Milano

1043 Messaggi |
 Inserito il - 20 giugno 2011 : 21:08:57 Inserito il - 20 giugno 2011 : 21:08:57




|
Senz'altro, io però finirò di prepararlo appena finita questa sessione d'esame per settembre, adesso penso ad altri esami; ho ancora quasi tutta la parte del metabolismo 
Sto studiando dal Lehninger, tu invece? |
 |
|
|
LorenZ
Nuovo Arrivato

95 Messaggi |
 Inserito il - 21 giugno 2011 : 12:48:13 Inserito il - 21 giugno 2011 : 12:48:13




|
| Anch'io sto studiando sul Lehninger, ma certi argomenti li guardo pure sul Voet. |
 |
|
| |
Discussione |
|





 , se dovessi avere dubbi invia un pm o edita un post che siamo sulla stessa barca!
, se dovessi avere dubbi invia un pm o edita un post che siamo sulla stessa barca!