| Autore |
Discussione |
|
|
hiero
Nuovo Arrivato

28 Messaggi |
 Inserito il - 18 gennaio 2014 : 16:53:44 Inserito il - 18 gennaio 2014 : 16:53:44




|
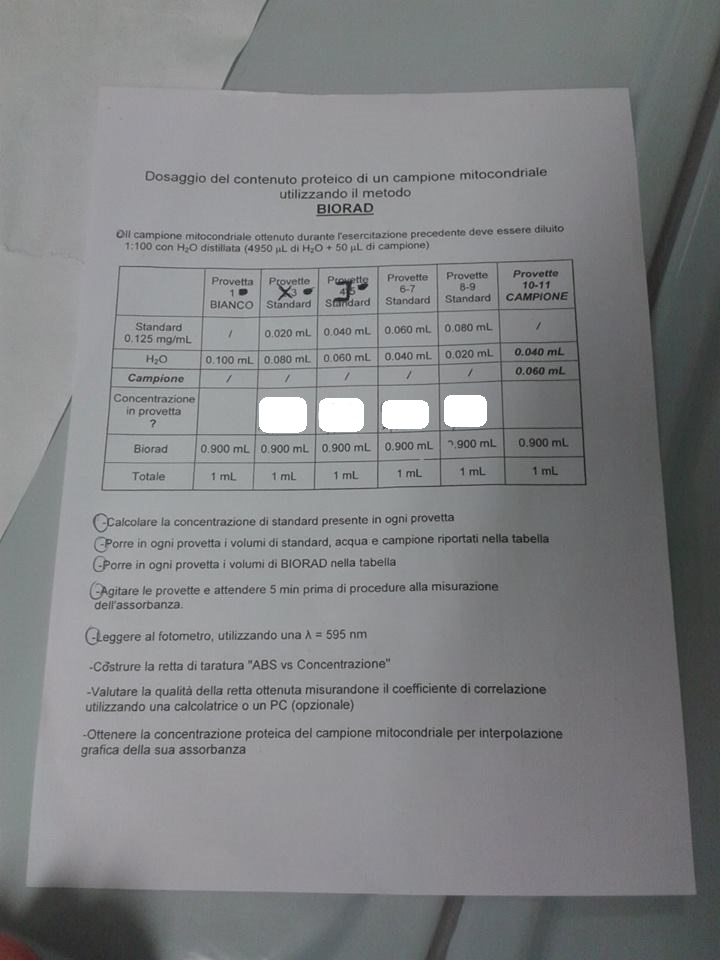
salve a tutti.
metto in allegato un esercizio.
Vorrei capire come faccio a calcolarmi la concentrazione di standard nelle provette e poi, una volta costruita la retta di taratura
come trovarmi il valore preciso della concentrazione del campione corrispondente all'assorbanza.
grazie anticipatamente.
Immagine:
113,63 KB
|
|
|
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 18 gennaio 2014 : 18:01:30 Inserito il - 18 gennaio 2014 : 18:01:30




|
Citazione:
come faccio a calcolarmi la concentrazione di standard nelle provette
http://www.molecularlab.it/principi/calcoli-laboratorio/ (o un qualsiasi libro di chimica, veramente)
Citazione:
una volta costruita la retta di taratura come trovarmi il valore preciso della concentrazione del campione corrispondente all'assorbanza
Una volta che hai l'equazione della retta (concentrazione = a * assorbanza + b) sostituisci il tuo valore di assorbanza e trovi la concentrazione. Se cerchi nel forum l'argomento è già stato trattato più volte (e sono sicuro al 95% di aver messo anche dei grafici con calcoli e tutto...) |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
hiero
Nuovo Arrivato

28 Messaggi |
 Inserito il - 19 gennaio 2014 : 18:10:53 Inserito il - 19 gennaio 2014 : 18:10:53




|
standard 0,125 mg/ml sarebbe la concentrazione di standard in un ml?
ad ogni modo le concentrazioni che mi sono ottenuto sono
provetta 2-3--->0,0025 mg/ml
provetta 4-5--->0,005 mg/ml
provetta 6-7--->0,0075 mg/ml
provetta 8-9--->0,01 mg/ml
sono giuste? |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 19 gennaio 2014 : 18:51:30 Inserito il - 19 gennaio 2014 : 18:51:30




|
Ti sei perso un fattore 10...
Ad es: provetta 4-5
- lo standard è 0.125 mg/ml
- ne prendi 0.040 ml, quindi 0.125 mg/ml * 0.040 ml = 0.005 mg
- il volume finale sarà di 0.04 + 0.06 = 0.1 ml
- la concentrazione sarà di 0.005 ml / 0.1 ml = 0.05 mg/ml
Oppure, ragionamento alternativo
- metti 0.040 ml di standard in 0.1 ml di volume finale, si tratta quindi di una diluizione 1:2.5 (=0.1/0.04)
- lo standard è 0.125 mg/ml, quindi diluito 1:2.5 sarà 0.125/2.5 = 0.05 mg/ml |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
hiero
Nuovo Arrivato

28 Messaggi |
 Inserito il - 19 gennaio 2014 : 19:39:16 Inserito il - 19 gennaio 2014 : 19:39:16




|
poi mi dovrò costruire la retta. il procedimento è questo(correggimi se sbaglio):
calcolare le assorbanze
riportare sul grafico i punti noti (assorbanza vs concentrazione)
trovare l'equazione della retta (retta passante per 2 punti)e quindi trovarmi per interpolazione la concentrazione del campione di cui conosciamo solo l'assorbanza.
Giusto?
|
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 19 gennaio 2014 : 19:46:38 Inserito il - 19 gennaio 2014 : 19:46:38




|
Esatto, tranne questo:
Citazione:
trovare l'equazione della retta (retta passante per 2 punti)
di punti ne hai 4...
Di solito si usa il metodo dei minimi quadrati. |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
hiero
Nuovo Arrivato

28 Messaggi |
 Inserito il - 19 gennaio 2014 : 19:48:06 Inserito il - 19 gennaio 2014 : 19:48:06




|
non basta prendere 2 punti a caso dei 4?
se non ti chiedo troppo potresti farmi un esempio con il metodo dei minimi quadrati? leggendo su wikipedia ci ho capito ben poco.
|
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
|
|
hiero
Nuovo Arrivato

28 Messaggi |
 Inserito il - 20 gennaio 2014 : 16:58:58 Inserito il - 20 gennaio 2014 : 16:58:58




|
i minimi quadrati è il metodo più semplice?
purtroppo l'esame non prevede l'uso di excel.
|
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 20 gennaio 2014 : 19:41:39 Inserito il - 20 gennaio 2014 : 19:41:39




|
I minimi quadrati è il metodo (o uno dei metodi) più corretto ed è quello che si usa nella realtà.
Cosa vogliano sapere all'esame non so dirti... dovresti chiederlo al prof! |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
| |
Discussione |
|





