| Autore |
Discussione |
|
|
Elly.a86
Nuovo Arrivato

5 Messaggi |
 Inserito il - 12 marzo 2010 : 09:19:40 Inserito il - 12 marzo 2010 : 09:19:40




|
Ciao ragazzi!
ho bisogno di voi!!
Sto purificando del DNA plasmidico linearizzato attraverso la solita e banale precipitazione in EtOH.
Protocollo in breve : aggiungo 2.5vol EtOH 96%, lascio overnight a -20°C, centrifugo 4°C per 30', elimino surnatante, aggiungo eccesso di EtOH 70%, centrifugo 30' a 4°C, elimino il surnatante, lascio asciugare bene. Aggiungo H2O o TE.
Insomma, il classico protocollo. Fatto sta che, sebbene io veda perfettamente il pellet sia dopo la prima centrifugazione che dopo la seconda, quando risospendo, la quantificazione allo spettrofotometro mi fornisce delle concentrazioni irrisorie.
Per farvi un'idea : digerendo 5ug (5000ng) ottengo circa 200ng totali.
Perchè !? Secondo me è un problema di risospensione..come posso risolverlo ?!
AIUTOOOOOO !!! SONO DISPERATAAA! 
Grazie a tutti
|
|
|
|
|
Neuroscience
Utente
 

659 Messaggi |
 Inserito il - 12 marzo 2010 : 10:46:01 Inserito il - 12 marzo 2010 : 10:46:01




|
Ti sei ricordata di aggiungere 1/10 volume di NaAc 3M pH 5, e di agitare bene prima di aggiungere l'Alcool?
Prova a caricare una aliquota su gel, prima e dopo la digestione. Es 1/10 di volume prima e dopo la precipitazione, quello che vedi potrebbero essere sali, proteine, o altre schifezze che si accumulano sul fondo.
In ultima analisi, sebbene sia difficile, potresti aver sbagliato il calcolo allo spettrofotometro. Carica su gel per essere sicura.
p.s. non è necessario o.n. a -20 °C, basta una mezz'ora, possibilmente in ghiaccio o in un cooler a -20°C.
 |
 |
|
|
Elly.a86
Nuovo Arrivato

5 Messaggi |
 Inserito il - 16 marzo 2010 : 09:25:02 Inserito il - 16 marzo 2010 : 09:25:02




|
Ciao! Grazie infinite per la risposta, ma ahimè ho già provato a fare tutto quello che consigli. Con pessimi risultati.
Leggo sia allo spettrofotometro normale che al nanodrop, su almeno due apparecchi diversi per tipo.
Faccio gel prima dopo e durante.
Metto il Na-Ac, precedentemente filtrato e pHato. Tutte le soluzioni sono preparate con materiale sterile, con acqua per iniettabili sterili.
Ho provato diversi tempi di incubazione a diverse temperature.
Insomma, ho considerato tutte le variabili possibili,le ho esaurite, ed ho iniziato a considerare le variabili impossibili arrivando a pensare che le eppendorf che uso (non marca Eppendorf) influiscano in qualche modo sulla risospensione..
Non c'è verso.
|
 |
|
|
Elly.a86
Nuovo Arrivato

5 Messaggi |
 Inserito il - 16 marzo 2010 : 09:38:23 Inserito il - 16 marzo 2010 : 09:38:23




|
La domanda chiave è PERCHE' IL DNA NON DOVREBBE RISOSPENDERSI !?
Il pellet lo vedo chiaramente sia dopo la pp EtOH96% che dopo i lavaggi in EtOH al 70%.
Lo lascio asciugare all'aria. E da lì in poi il DNA sparisce misteriosamente.
Perchèèèè ??? 
|
 |
|
|
Neuroscience
Utente
 

659 Messaggi |
 Inserito il - 16 marzo 2010 : 09:51:01 Inserito il - 16 marzo 2010 : 09:51:01




|
Ci sono circa 200 motivi per cui il dna può non risospendere.
Il motivo più banale è che lo hai seccato troppo.
Non devi tenerlo troppo all'aria, io generalmente lo centrifugo per recuperare le ultime gocce di alcool, le tolgo con la pipetta, e subito aggiungo il TE. La risospensione è quasi immediata.
Altrimenti dovresti sperare di risospendere il DNA per qualche ora a 37°C sotto agitazione, oppure o.n. 4°C in TE.
Altri motivi possono riguardare principalmente le contaminazioni, lo scarso volume di solvente, l'eccessiva quantità di ioni etc etc.
 |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
|
|
Soshi Fujiwara
Nuovo Arrivato


60 Messaggi |
 Inserito il - 16 marzo 2010 : 14:02:31 Inserito il - 16 marzo 2010 : 14:02:31




|
Stenterete a crederci, perchè anche a me era capitata una cosa del genere e risolsi cambiando le provette!! 
Può sembrare assurdo, ma usavo delle provette scadenti che costavano poco e per qualche motivo, un pò sul ridere, stabilimmo su due piedi che il DNA doveva per qualche motivo stabilire un legame covalente con la plastica della provetta!! Succedeva la stessa cosa: avevo quintali di genomico che poi si riducevano a pochissimi ng!
Faceva fatica a risospendersi sia in TE che in H2O, talvolta rimaneva il pellet galleggiante nel liquido senza che succedesse nulla.
Alla fine ho cambiato marca delle provette e il problema si è risolto!
Sono il primo a sostenere che il problema dovesse essere un'altro perchè la cosa ha dell'incredibile, ma tutto si risolse!! |
 |
|
|
Neuroscience
Utente
 

659 Messaggi |
 Inserito il - 16 marzo 2010 : 19:36:39 Inserito il - 16 marzo 2010 : 19:36:39




|
Per quanti laboratori sono passato mi hanno tutti confermato questo fatto, il DNA genomico non va mai seccato.
Ricordo anche che quando facevo i Southern per lo screening dei topi transgenici la prima difficoltà era proprio dover seccare la piastra con i 96 cloni. Il dna che ne usciva (dalle piastre secche) non si risospendeva subito in acqua, c'era bisogno di 2-3 ore a 37°C sotto agitazione (pericoloso) oppure o.n. a 4°C (via più sicura).
Idem con le genotipizzazioni dei topi.
Personalmente non mi è mai capitato problemi con le provette, anche se ne ho cambiate tante, tuttavia se lasci il DNA genomico seccare troppo ci vuole un sacco di tempo per risospenderlo. Per me è esperienza quotidiana dato che, con i miei tesisti, facciamo circa 400 genotipizzazioni al mese.
Quando lasci seccare troppo dopo il DNA, a volte addirittura si forma una pallina di genomico che fluttua nel TE. Ci vogliono tante ore per dissolverlo nuovamente.
Con meno difficoltà anche il DNA plasmidico si risospende male quando è seccato.
Quello che dice Soshi l'ho sentito dire anche da altri, ma in altre situazioni non nella precipitazionecasi... se ricordo bene era con la speedvac, non si doveva seccare troppo la soluzione con il DNA o proteine in speedvac poiché secondo alcuni evaporava il DNA (!?!?) secondo altri si attaccava alla plastica.
Infatti in un laboratorio in cui sono stato le soluzioni di DNA venivano seccate solo in un particolare tubo (forse Corex, non ricordo). Però non ho mai approfondito più di tanto la mia curiosità.
Sinceramente io terrei in considerazione questi due fatti...
1) non seccare troppo il DNA,
2) provare a fare la precipitazione in altre provette.
|
 |
|
|
Neuroscience
Utente
 

659 Messaggi |
 Inserito il - 16 marzo 2010 : 19:41:52 Inserito il - 16 marzo 2010 : 19:41:52




|
Tuttavia, ci sono delle domande tecniche che vorrei fare.
1) hai detto che vedi il precipitato nel primo passaggio e nel secondo, quando è che non vedi più il pellet?
tieni presente che il DNA dovrebbe essere incolore quando è secco, generalmente bianco opaco in alcool. Quindi quando secchi l'alcool il DNA dovrebbe man mano diventare incolore.
2) quando aggiungi l'acqua vedi che si attacca sul fondo? senti che cambia viscosità? Hai provato a lasciare la risospensione o.n. a 4°C ?
in bocca al lupo
 |
 |
|
|
chick80
Moderatore
    

Città: Edinburgh

11491 Messaggi |
 Inserito il - 16 marzo 2010 : 20:04:27 Inserito il - 16 marzo 2010 : 20:04:27




|
| Boh, si vede che la quantità di DNA che ho quando faccio il genotyping è così grande che riesco a risospenderlo anche dopo averlo seccato o/n. |
Sei un nuovo arrivato?
Leggi il regolamento del forum e presentati qui
My photo portfolio (now on G+!) |
 |
|
|
Elly.a86
Nuovo Arrivato

5 Messaggi |
 Inserito il - 18 marzo 2010 : 11:32:48 Inserito il - 18 marzo 2010 : 11:32:48




|
In diretta dal bancone : ho provato a precipitare un DNA genomico che non sia il mio, con la tecnica che uso normalmente ma utilizzando delle eppendorf originali.
risultato : precipita e si risospende tutto magnificamente.
Ergo o il mio DNA è sporco da fare schifo (è un plasmide clonato in Coli da un altro laboratorio, quindi chi può sapere come lavorano là !?), oppure sono veramente le eppendorf.
Nel dubbio oggi ho fatto partire una purificazione del DNA plasmidico in fenolo/cloroformio seguita dalla precipitazione in Etanolo.
So che la resa farà più schifo del solito perchè la prima volta che si fa la fenolo/cloroformio si perde un sacco di materiale.
Speriamo bene, vi tengo aggiornati ! Grazie infinite nel frattempo :)
ps. anche io sapevo che il DNA non va mai tirato troppo a secco !! |
 |
|
|
beppe.cib
Nuovo Arrivato

41 Messaggi |
 Inserito il - 24 novembre 2010 : 22:10:45 Inserito il - 24 novembre 2010 : 22:10:45




|
Sto estraendo del DNA plasmidico da batteri attraverso due kit differenti (che utilizzano le colonnine). Arrivati alla fine il DNA plasmidico è disciolto nella soluzione eluente del kit.
Io vorrei precipitare il dna e risospenderlo in acqua perchè la soluzione eluente mi da fastidio per la PCR.
Come far precipitare il DNA? va bene aggiungere 2 volumi di etanolo a -20°C, centrifugare, asciugare l'etanolo, e aggiungere l'acqua?
Grazie. |
 |
|
|
SpemannOrganizer
Utente
 

Città: Los Angeles

955 Messaggi |
 Inserito il - 24 novembre 2010 : 23:50:12 Inserito il - 24 novembre 2010 : 23:50:12




|
mah, io eluirei direttamente con acqua anzichè con la soluzione fornita dal kit (che per la cronaca o è tris pH 8 o TE). Puoi anche riprecipitare, ma è un passaggio in piu' e comunque una ulteriore perdita di materiale. Parli di colonnine (spin columns?) quindi immagino che la tua sia una mini prep... guarda anche sul manuale, dovresti poter eluire con acqua senza problemi. L'unica cosa è che in genere eluisci un po' meno roba...
|
 |
 |
|
|
Martin.diagnostica
Utente Attivo
  


1582 Messaggi |
 Inserito il - 25 novembre 2010 : 00:22:41 Inserito il - 25 novembre 2010 : 00:22:41




|
Certo ke con queste miniprep fare le precipitazioni in etoh sembra di essere tornati 20 anni indietro, possibile che non ti comperano un kit con le spincolum??
Ma come mai lo stai purificando? devi fare una ligation? |
 |
|
|
beppe.cib
Nuovo Arrivato

41 Messaggi |
 Inserito il - 25 novembre 2010 : 17:12:19 Inserito il - 25 novembre 2010 : 17:12:19




|
Il kit ha le spincolum, ma abbiamo avuto un problema con la soluzione eluente. Altro problema ho provato a digerire con ecoR1 il plasmide che dovrebbe essere tagliato e dare due pezzi di 378 e 4686. Facendolo correre in agarosio 1,8% questo è il risultato (la prima immagina è dopo un'ora di corsa, la seconda dopo un'ora e mezza a 110V:
Immagine:
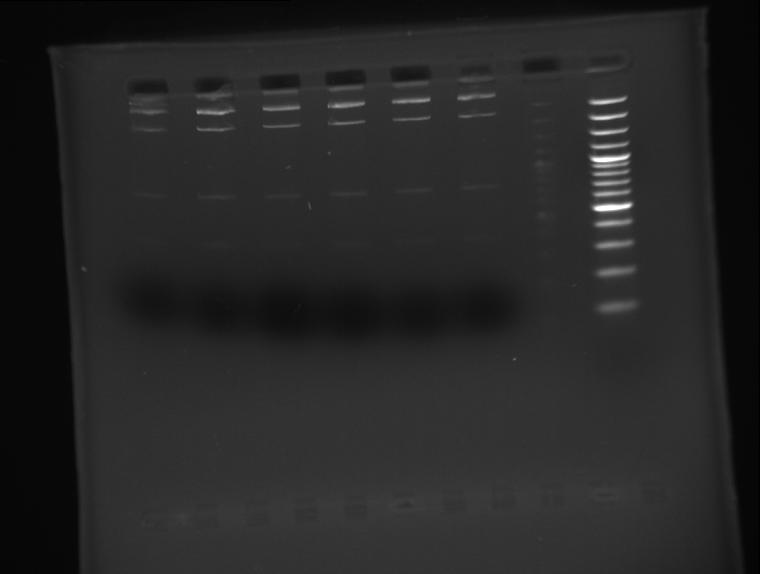
21,58 KB
Immagine:
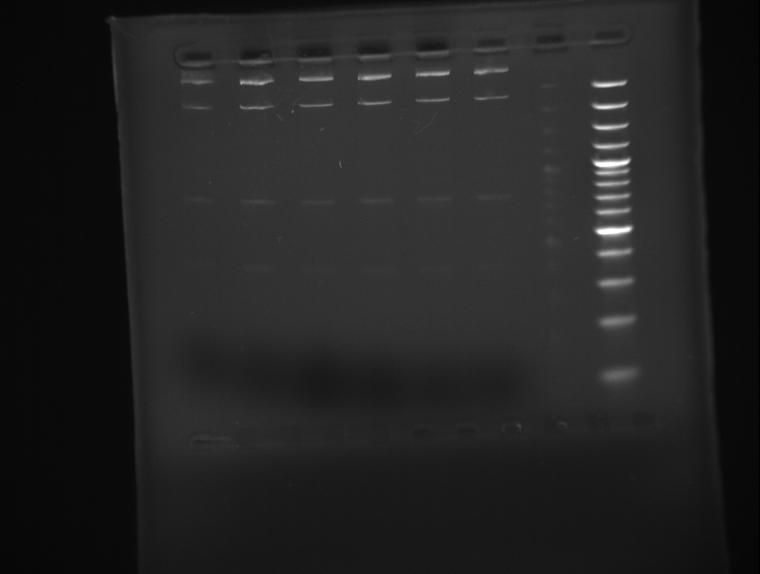
21,22 KB
Perchè le bande sono 4 e non tre come dovrebbero essere?
Grazie |
 |
|
|
stamina89
Nuovo Arrivato

1 Messaggi |
 Inserito il - 11 maggio 2016 : 13:54:09 Inserito il - 11 maggio 2016 : 13:54:09



|
Citazione:
Messaggio inserito da chick80
Perchè seccandolo troppo non si dovrebbe risospendere?
Io lo lascio seccare o/n e non ho mai avuto problemi...
Salve a tutti, scusate se farò qualche errore qui da poco.
Anche a me è capitata la medesima cosa con un pellet di genomico che non ne vuole sapere di risospendersi, o meglio non vuole risospendersi.
Potreste darmi qualche consiglio.
Graze |
 |
|
| |
Discussione |
|










