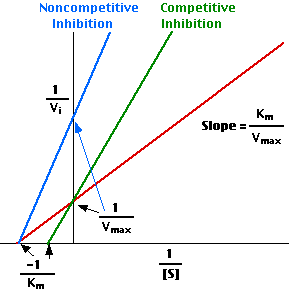
Per gli inibitori non competitivi, col metodo dei doppi reciproci, non si ottengono rette parallele, ma come dici tu, si ottengono rette che hanno la stessa intercetta sull'asse dell x (stessa Km) ma diversa intercetta sull'asse delle y (diversa Vmax).
In sostanza varia la pendenza della retta che è data da
Km
----
Vmax
Ovviamente, in presenza dell'inibitore, essendo minore la Vmax, la retta avrà pendenza maggiore!
Immagine:
4,47 KB
In realtà l'inibitore può reagire sia con il complesso ES sia con E (enzima libero). In genere il substrato può legarsi ma non avviene la catalisi. A livello pratico è come se [Et] (enzima totale) fosse minore.
Data la reazione generale:
k1 k2
S + E <------> ES <------> P + E
Visto che la Vmax si raggiunge quando l'enzima è saturato [ES]=[Et], si può dire che:
Vmax = K2 [Et]
Si deduce quindi che la Vmax è direttamente proporzionale alla quantità di enzima e per questo motivo, in caso di presenza dell'inibitore non competitivo, è minore.
Spero di essere stato chiaro. In caso chiedi!







